Közhelyes, de ismeretterjesztők és oktatók számára ma is aranyszabály, hogy egy jó kép, vagy hatásos videó néha többet ér száz szónál. A Science-ben most megjelent ún. MEGA-plate kísérlet, ahol lényegében egy hatalmas Petri-csészén élőben figyelik, hogy miként alakul ki az antibiotikum rezisztencia eredetileg nem rezisztens baktériumokban, pont egy ilyen videót ad mindenki kezébe, mert ennél szemléletesebben tényleg nem nagyon lehet ezt már csinálni. (A ráérősebbeknek érdemes a The Atlantic cikket elolvasni, ahol a kísérlet háttérsztorijáról, a berendezés összeállításáról is bővebben írnak.)
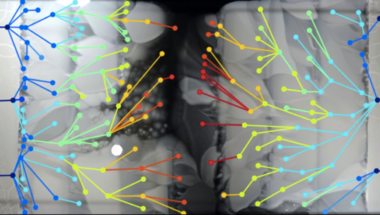
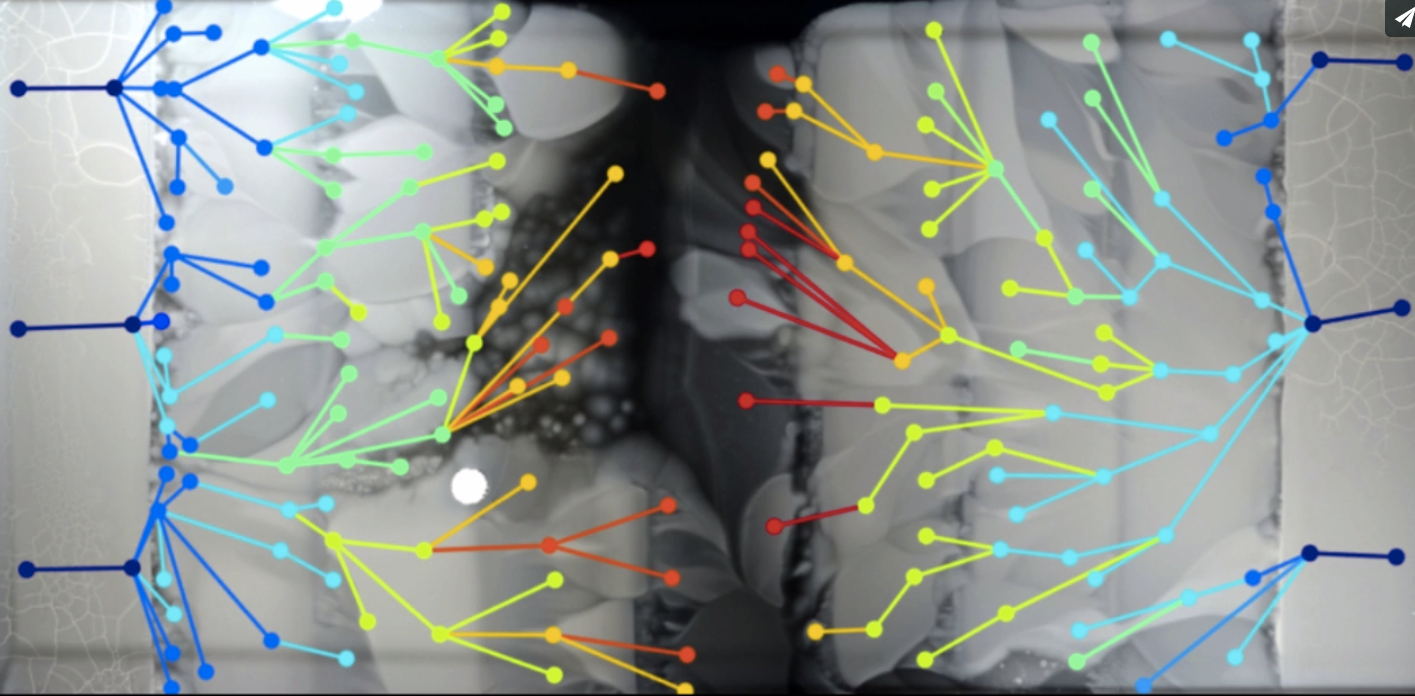
A "hatalmas Petri csésze" ez esetben egy 120x60 cm-es kád, aminek a széleire antibiotikum-mentes táptalajt öntenek, majd befele haladva fokozatosan elkezd növekedni az antibiotikum (az alábbi videón ciprofloxacin) koncentráció, középen elérve annak az ezerszeresét, amit így-úgy egy baci még tolerálna. Egy kiindulásként használt E. coli baktériumnak annyi esélye sem lenne itt, a kád közepén, mint hópihének a tokamak reaktorban. Az egész kád tetejét lágyagarral borítják (ami segíti a baktériumok mozgását), majd a két szélét beoltják antibiotikum érzékeny baktériumokkal. És várnak.
Az elején, az antibiotikumot nem tartalmazó részekben gyorsan elszaporodnak a baktériumok, de amikor a koncentráltabb részekhez éllnek, leáll a növekedés. Aztán előbb-utóbb megjelenik egy-két egyed, aki képes az alacsony antibiotikum koncentrációt már egész jól tolerálni, és folytatódik a növekedés (ha több ilyen - feltehetőleg külön mutáció miatt megjelenő - baktérium is megjelenik, azok klonális leszármazottai egymással is versenyeznek az új élettér betöltéséért). Az újabb antibiotikum koncentráció ugrásnál, ugyanez figylehető meg és így tovább. Végül az egész lemezt benövik a telepek. Innen már az lesz az érdekes kérdés, hogy hogyan történt mindez?
A különböző vonalak genomjának megszekvenálása azt mutatja, hogy akárcsak Richard Lenski klasszikus kísérletében, itt is az adaptálódó vonalak jelentős része kifejlesztett ún. mutátor mutációkat, vagyis olyan mutációkat, amelyek a baktérium saját hibajavító mechanizmusait gyengítették, így megnövelve annak az esélyét, hogy máshol mutáció jelenjen meg (nyilván, ilyenkor számos káros, vagy épp letális mutáció is feltűnik, de ezek gyorsan kiszelektálódnak, viszont az adott (antibiotikus) közegben hasznos, a növekedést elősegítő mutációk is nagyobb eséllyel tűnhetnek fel. Jelen esetben a leggyakrabban olyan mutációk jelentek meg, amelyek az egyik DNS másolásért felelős enzimet, a DNS-polimeráz III-t kódoló dnaQ gént érintették, annak hibafelismerési képességeit rontva. De nemcsak ilyen utat járhatott be a rezisztencia kialakulása, hanem néha egyszerűen annak az anyagcsere útvonalnak a mutációit láthatjuk, amelyre az adott antibiotikum hatna.
A MEGA-plate is jól mutatja azt a korábban már ismert jelenséget, hogy a rezisztencia megjelenése valamilyen trade-off-al jár, vagyis valamit-valamiért alapon, a sejtek ugyan képesek lesznek életben maradni adott antibiotikum mellett, de cserébe pl. lassabban növekednek, ritkábban osztódnak. Ilyenkor, a fent már említett klonális versengés miatt sokat érhet, ha kialakulnak ún. kompenzáló mutációk, amelyek meggyorsítják az adott vonal növekedését.
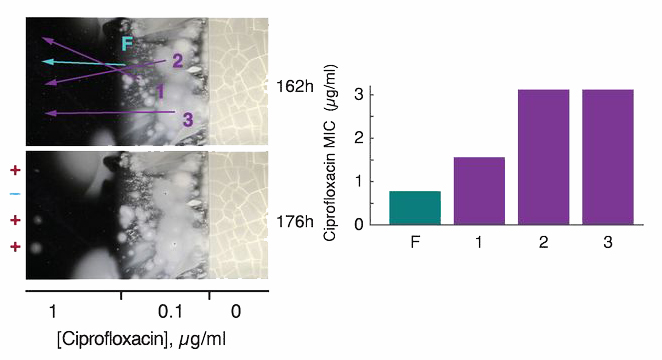
A kísérlet egy másik érdekes megfigyelése, hogy gyakran a tulajdonképpen legrátermettebb vonalak nem is pont a baktériumpázsit terjedési frontjában alakulnak ki, hanem mögötte (pont az előbb említett kompenzáló mutációknak köszönhetően). Például az alábbi ábrán látható, hogy a terjedési frontról származó izolátum (F) egyáltalán nem képes (még) nőni a nagyobb koncentráción, mígy a mögötte található telepekben kialakult klónok (1, 2, 3) már teljesen fittek ahhoz, hogy a magas antibiotikum koncentráció mellett is életben maradjanak, csak épp a köréjük nőtt más/kiindulási klónból származó baktériumok behatárolják a növekedésüket.
Mi következik ebből az egészségügyre vonatkozóan? A kísérlet nagyon szemléletes demonstrációja annak, amit már amúgy is sejtettünk/tudtunk, vagyis a nem megfelelő, szuboptimális antibiotikum-kúra nagyban elősegíti a rezisztencia megjelenését. Ami aztán könnyen elterjedhet, olyan multidrog rezisztens baktériumokat megjelenését katalizálva, akikkel szemben tehetetlenek vagyunk mai eszközeinkkel. Ezért is veszélyes túl gyakran felírni antibiotikumot, azt nem beszedni (vagy az állattenyésztésben meggondolatlanul adagolni).
És ez persze még csak nem is a teljes kép: a valóság az, hogy egyelőre nincsenek saját fejlesztésű "eredeti" antibiotikumjainak. A gyógyszeripar eddig inkább csak olyan reagensekre talált rá, ami a mikróbák egymás ellen irányuló fegyverkezési versenyének évmilliók alatt kialakult termékei, és mint ilyen, gyakran az "ellenszerük" is létrejött már az evolúció során. Ezek az ellenszerek pedig hihetetlenül gyorsan tudnak terjedni a horizontális géntranszfer (HGT) segítségével baktériumok között, még inkább meggyorsítva a rezisztens törzsek megjelenését hétköznapjainkban.
(A korábbi években Szegeden az SZBK-ban egy nagyon hasonló kísérletet csináltak Pál Csabáék laboratóriumában a Kutatók Éjszakájára, talán az idén is alkalom lesz erre.)
Baym M, Lieberman TD, Kelsic ED, Chait R, Gross R, et al. (2016) Spatiotemporal microbial evolution on antibiotic landscapes. Science 353(6304): 1147-51.