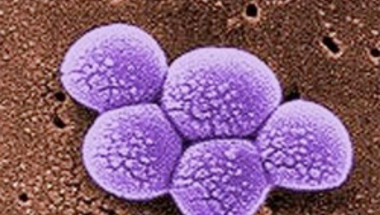
 Napjaink alulértékelt, de komolyan veendő problémáinak egyike az antibiotikumrezisztens bakteriális kórokozók terjedése. A Távol-Keleten lappangó madárinfluenza variánsokkal egyetemben, ezeknek van a legnagyobb esélye arra, hogy globális káoszt okozzanak.
Napjaink alulértékelt, de komolyan veendő problémáinak egyike az antibiotikumrezisztens bakteriális kórokozók terjedése. A Távol-Keleten lappangó madárinfluenza variánsokkal egyetemben, ezeknek van a legnagyobb esélye arra, hogy globális káoszt okozzanak.
A probléma persze nem teljesen váratlan, sőt ha jobban megnézzük kialakulásában igen jelentős és jól dokumentált szerepet játszottunk mi magunk, emberek is.
Az egyes antibiotikumokkal szembeni rezisztencia ugyanis minden esetben szabványos természetes szelekcióval alakult ki: az alkalmazásukkal egyetemben szelekciós nyomás alakult ki a bakteriális célpopuláción, amelynek eredményeképpen a "célcsoport" vagy elpusztult (szerencsére ez volt a gyakoribb), vagy egy-két mutáns "hírvivő" révén fennmaradt. Ez azzal magyarázható, hogy az antibiotikum kezeléssel párhuzamosan természetesen a baktériumok a szervezetben tovább osztódtak, és minden egyes osztódás során bizonyos valószínűséggel mutációkat szedhettek össze. Ha megfelelő mutáció jön létre, akkor a baci kikerüli az antibiotikumok hatását, rezisztensé válik és vidáman osztódik tovább.
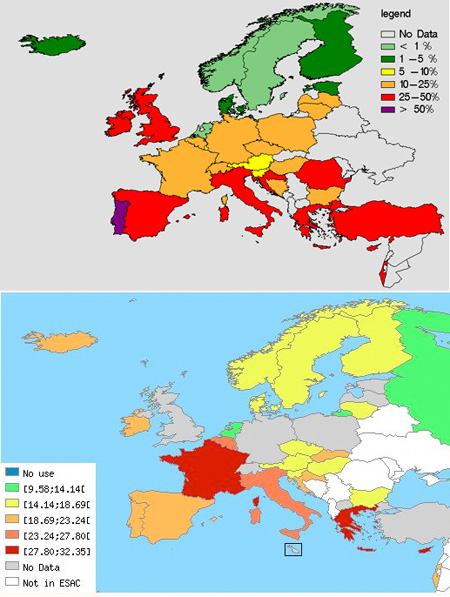 Mivel sok beteget kezelnek antibiotikummal, ráadásul minden betegben milliószámra hemzsegnek a bacik, a nagy számok törvénye alapján előbb-utóbb biztos lesz alkalom a megfelelő mutáció megjelenésére. Sőt ebből a kis szabályból az is levezethető könnyen, hogy minél elterjedtebb az antibiotikumhasználat, annál gyorsabb lesz a rezisztencia kialakulása. (Megspékelve mindezt azzal, hogy a baktériumok képesek kisebb DNS darabokat ún. "horizontális géntranszferrel" is terjeszteni, igazából sejthető, hogy a baktériumok számára hasznos mutációk tűzvész gyorsaságával képesek elterjedni.) Ez pedig nemcsak elméleti szépelgés, hanem olyasmi, amit alátámaszt az empirikus megfigyelés is: ha összevetjük a European Antimicrobial Resistance Surveillance System (EARSS) keretén belül gyűjtött adatokat a European Surveillance of Antimicrobial Consumption (ESAC) felméréssel, az összefüggés, ha nem is tökéletes, de szembetűnő.
Mivel sok beteget kezelnek antibiotikummal, ráadásul minden betegben milliószámra hemzsegnek a bacik, a nagy számok törvénye alapján előbb-utóbb biztos lesz alkalom a megfelelő mutáció megjelenésére. Sőt ebből a kis szabályból az is levezethető könnyen, hogy minél elterjedtebb az antibiotikumhasználat, annál gyorsabb lesz a rezisztencia kialakulása. (Megspékelve mindezt azzal, hogy a baktériumok képesek kisebb DNS darabokat ún. "horizontális géntranszferrel" is terjeszteni, igazából sejthető, hogy a baktériumok számára hasznos mutációk tűzvész gyorsaságával képesek elterjedni.) Ez pedig nemcsak elméleti szépelgés, hanem olyasmi, amit alátámaszt az empirikus megfigyelés is: ha összevetjük a European Antimicrobial Resistance Surveillance System (EARSS) keretén belül gyűjtött adatokat a European Surveillance of Antimicrobial Consumption (ESAC) felméréssel, az összefüggés, ha nem is tökéletes, de szembetűnő.
Mindenesetre a napokban újabb érvvel gazdagodtak azok, akik a nyakló nélküli antibiotikumfogyasztás ellen kampányolnak: egy új tanulmány azt mutatta ki, hogy a szubletális (vagyis az elpusztításhoz szükségesnél kisebb dózisban) adagolt antibiotikum, megnöveli a rezisztencia kialakulását - ráadásul nem egyszerűen azért, mert szelekció van.
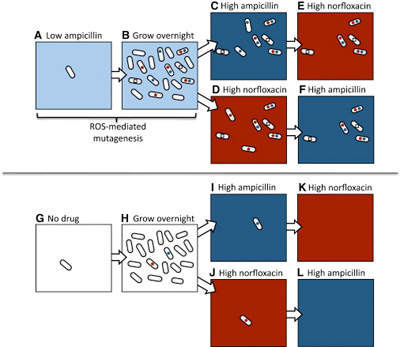 Az antibiotikumok hatásmechanizmusának egyik utolsó lépése általában ún. reaktív oxigénszármazékok (ROS) segítségével zajlik: ezek - mint nevük is mutatja - nagy valószínűséggel reakcióba lépnek a környékükön levő molekulákkal (cukrokkal, fehérjékkel, nukleinsavakkal egyaránt), azokat működésképtelenné téve. Most azonban kiderült, hogy a sejtekben megjelenő ROSok mennyisége arányos az alkalmazott antibiotikumok arányával, vagyis szubletális dózisnál is felszabadul belőlük egy kis mennyiség. Ez ahhoz kevés, hogy a sejtet elpusztítsa, ahhoz viszont elég, hogy a DNS-ben hibákat hozzon létre, vagyis megnövelje a mutációk számát, az ún. mutációs rátát.
Az antibiotikumok hatásmechanizmusának egyik utolsó lépése általában ún. reaktív oxigénszármazékok (ROS) segítségével zajlik: ezek - mint nevük is mutatja - nagy valószínűséggel reakcióba lépnek a környékükön levő molekulákkal (cukrokkal, fehérjékkel, nukleinsavakkal egyaránt), azokat működésképtelenné téve. Most azonban kiderült, hogy a sejtekben megjelenő ROSok mennyisége arányos az alkalmazott antibiotikumok arányával, vagyis szubletális dózisnál is felszabadul belőlük egy kis mennyiség. Ez ahhoz kevés, hogy a sejtet elpusztítsa, ahhoz viszont elég, hogy a DNS-ben hibákat hozzon létre, vagyis megnövelje a mutációk számát, az ún. mutációs rátát.
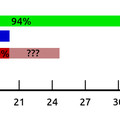
És mivel a mutációk "vakon" születnek, az alacsony dózisban alkalmazott ampicillin ugyanakkora eséllyel hoz létre ampicillin-rezisztenciát, mint norfloxacin-rezisztenciát, hiába van teljesen más molekulacsaládokról szó.
Kaufmann BB, Hung DT (2010) The Fast Track to Multidrug Resistance Molecular Cell 37(3): 297-298.
Kohanski MA, DePrsito MA, Collins JJ (2010) Sublethal Antibiotic Treatment Leads to Multidrug Resistance via Radical-Induced Mutagenesis Molecular Cell 37(3): 311-320.