 Az aminosavsorrend adja a fehérjék elsődleges szerkezetét, az aminosavlánc aztán különféle másodlagos struktúrákat vesz fel, mint például az alfa-hélix vagy a beta-redő, ezek aztán különféle harmadlagos szerkezetekbe rendeződnek, így alakítva ki az adott fehérje háromdimenziós térszerkezetét. E szerkezet alapvetően határozza meg a fehérje funkcióját – egy enzim aktív centrumába, egy receptorfehérje ligandkötő doménjébe, egy adott transzportfehérjéhez csak egy bizonyos szerkezettel rendelkező vegyület(csoport) képes kapcsolódni. De mi a helyzet azokkal a fehérjékkel, amiknek nincs a klasszikus értelemben vett harmadlagos szerkezetük?
Az aminosavsorrend adja a fehérjék elsődleges szerkezetét, az aminosavlánc aztán különféle másodlagos struktúrákat vesz fel, mint például az alfa-hélix vagy a beta-redő, ezek aztán különféle harmadlagos szerkezetekbe rendeződnek, így alakítva ki az adott fehérje háromdimenziós térszerkezetét. E szerkezet alapvetően határozza meg a fehérje funkcióját – egy enzim aktív centrumába, egy receptorfehérje ligandkötő doménjébe, egy adott transzportfehérjéhez csak egy bizonyos szerkezettel rendelkező vegyület(csoport) képes kapcsolódni. De mi a helyzet azokkal a fehérjékkel, amiknek nincs a klasszikus értelemben vett harmadlagos szerkezetük?
Jó néhány éve volt már, hogy Dénessel órákon át ültünk a spektrofotométer előtt, és a hődenaturált citrát szintáz fényszórásának változását mértük két általa izolált, chaperonnak gondolt rendezetlen fehérje jelenlétében. Végül többféle méréssel is sikerült igazolnunk, hogy az ERD10 és ERD14 nevű fehérjék ténylegesen dajkafehérjeként működnek, vagyis más fehérjéknek segítenek abban, hogy a térszerkezetüket felvegyék illetve megőrizzék. E két fehérje a rendezetlen fehérjék közé tartozik, teljesen funkcionális állapotukban is rendezetlenek vagyis nincs stabil, jól definiálható harmadlagos szerkezetük (IDPs - intrinsically disordered proteins). Ezek struktúrálisan a globuláris fehérjék denaturált állapotaira emlékeztetnek [1]. Azóta egyre több, akár eddig is ismert proteinről derül ki, hogy nincsen meghatározható térszerkezete, sőt a másodlagos struktúrákban sem bővelkedik. A humán gének 40%-a kódol olyan fehérjét, amelynek legalább az egyik doménje, míg negyedük olyat, amely teljesen egészében rendezetlen [2]. Többségük igencsak “befolyásos” protein (mint például a p53, BRCA1, CREB, RNS-polimeráz II, illetve az alfa-szinuklein), általában a jelátvitelben, a transzkripcióban vagy a sejtciklus szabályozásában vesznek részt.
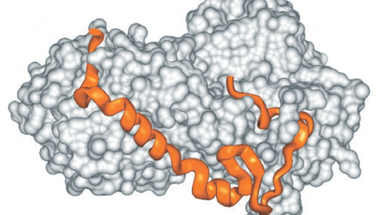
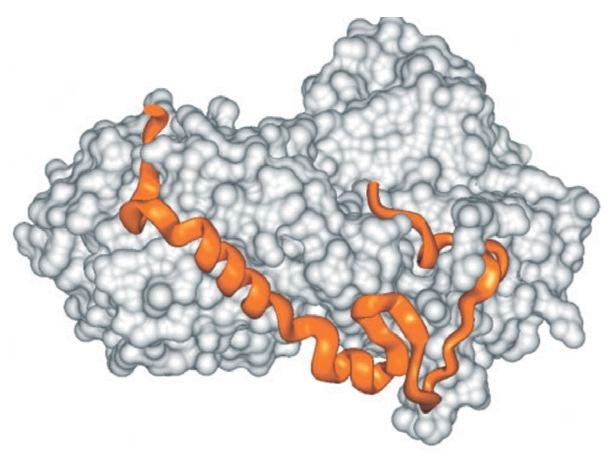
A rendezetlenség hátterében az áll, hogy az ilyen fehérjéket (vagy fehérje alegységeket) alkotó aminosavak (Ala, Arg, Gly, Gln, Ser, Pro, Glu és Lys) nagy nettó töltést és alacsony hidrofóbicitást biztosítanak a molekulának, ami miatt az nem tud kompakt, jól definiált térszerkezetet felvenni. Különböző fizikai illetve mikroszkópos (NMR, SAXS, AMF, smFRET) mérések alapján azonban ezek a fehérjék nem állandóan rendezetlenek, hanem különböző, funkcióhoz kötött átmeneti rövid- illetve hosszútávú szerkezetekkel rendelkeznek. Egyik szerkezet a másikba például egy másik molekulával történő kapcsolódás hatására alakul át. A rendezetlenségnek köszönhetően ezek a fehérjék nagyobb specifitással rendelkeznek (ami viszont nem jár a kötés erősségének növekedésével), gyorsabban képesek e specifikus kapcsolatok kialakítására, illetve több funkciót is képesek ellátni [3].
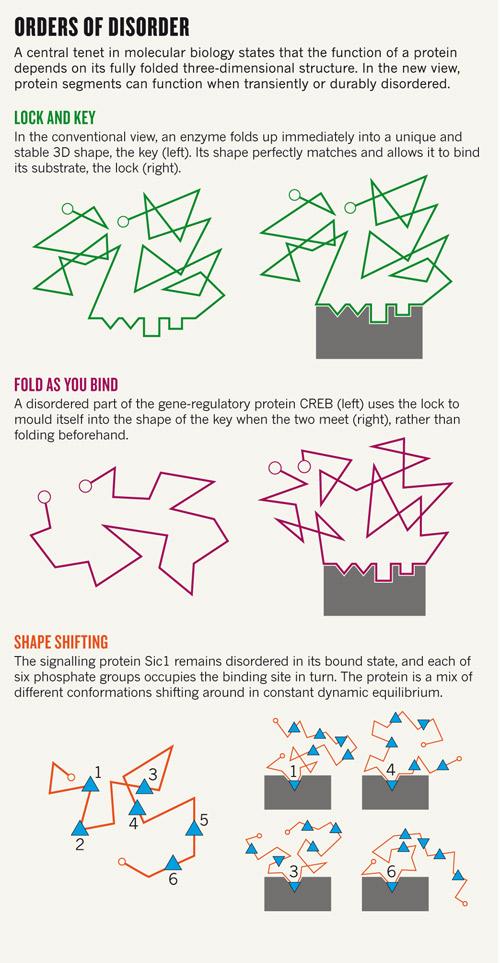
Ha a rendezetlen fehérjék létét nem is, de a működésük mechanizmusát sok kutató igencsak kételkedve fogadja. A klasszikus kulcs-zár elmélet ma már elfogad némi “lötyögést”, sőt, az allosztéria is leír interakció hatására végbemenő szerkezetváltozást, de azért a legtöbb old school fehérje-biokémikusnak a szerkezetfelismerés és a rendezetlen struktúra nem hozható egy napon szóba: “Olyan ez, mintha egy zárat egy főtt spagettivel akarnál kinyitni” – mondja a jelenségre Joël Janin, egy Gif-sur-Yvette-i szerkezetbiológus. Hihetetlennek hangzik, de - a hasonlatnál maradva - néhány esetben a spagetti (pl a CREB, lásd az alsó ábra közepén) a zárral kölcsönhatásba lépve a zárnak megfelelő kulcs alakját veszi fel. A Sic1 spagettije viszont úgy tűnik, hogy sosem vesz fel rendes harmadlagos szerkezetet, mégis kulcsszerepet játszik a sejtciklus szabályozásában [4].
Az eukarióta sejtekben található rendezetlen p53 vagy a BRCA1 jelátviteli folyamatok ún. központi fehérjéi (“hub proteins”), mivel nagyon nagy a kapcsolati tőkéjük (számtalan partnerrel képesek komplexet alkotni). Hozzájuk hasonlatosan rendezetlen “hub” az adenovirus 1A korai fehérje (E1A) is, amely sok gazdasejtbeli szabályozófehérjével tud kapcsolatot létesíteni, ezáltal fenekestül felforgatja a fertőzött sejt jelátviteli folyamatait. A Nature legfrissebbik számában arról számol be Ferreon, hogy attól függően, milyen fehérjével lép első körben kapcsolatba az E1A, a kapcsolat által létrejött allosztérikus térszerkezet-változások miatt különböző jelátviteli utakat aktivál. Ha az elsődleges partner a CBP/p300, akkor gének átíródását befolyásolja pozitív illetve negatív irányba (lásd a kör alakú ábra jobb alsó szeletét), ha a retinoblasztóma fehérjével (pRb) képez komplexet a CBP/p300 nélkül, akkor a sejtciklust pörgeti tovább (lásd a bal felső kvadránst), ha a komplexben mind a pRb, mind a CBP/p300 jelen van, akkor sejtdifferenciációt indukál (lásd a jobb felső körcikket) [5].
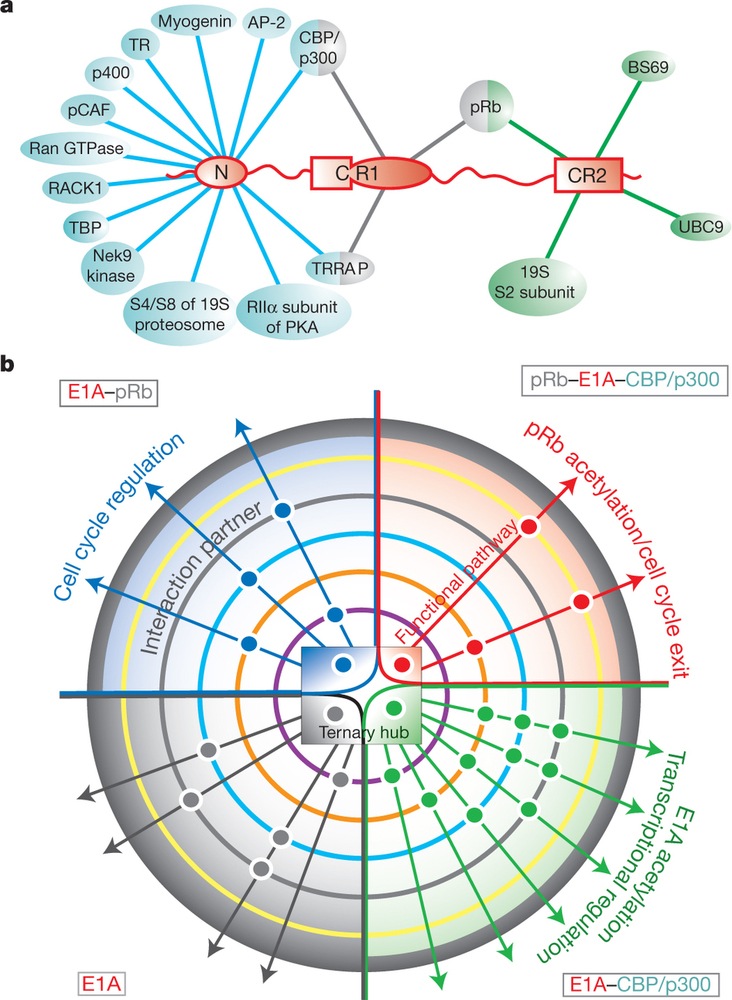
Bárhogy is lássák el feladatukat, a rendezetlen fehérjék mindenképpen újraformálják a proteinek szerkezetmeghatározásán alapuló funkciófelfogást. Vagy fogalmazzunk úgy, hogy újra kéne, hogy formálják? Merthogy egyenlőre a tudományos közösség még ott sem tart, hogy a rendezetlen fehérjék bekerüljenek a tankönyvekbe.
1. http://www.matud.iif.hu/2009/09jul/08.htm.
2. Uversky, V.N. and A.K. Dunker, Understanding protein non-folding. Biochim Biophys Acta, 2010. 1804(6): p. 1231-64.
3. Tompa, P., Unstructural biology coming of age. Curr Opin Struct Biol, 2011. 21(3): p. 419-25.
4. Chouard, T., Structural biology: Breaking the protein rules. Nature, 2011. 471(7337): p. 151-3.
5. Ferreon, A.C.M., et al., Modulation of allostery by protein intrinsic disorder. Nature, 2013. 498,
: p. 390–394