A mellékelt ábra pár héttel ezelőtt került fel az egyik Facebook csoportba és ugyan ott pillanatok alatt megszületett a helyes válasz (lásd alább) a felvetésre, azért az egykori kvízmester által felvetett kérdés nagyon is racionális és mindenképpen megér egy posztot.
A mellékelt ábra pár héttel ezelőtt került fel az egyik Facebook csoportba és ugyan ott pillanatok alatt megszületett a helyes válasz (lásd alább) a felvetésre, azért az egykori kvízmester által felvetett kérdés nagyon is racionális és mindenképpen megér egy posztot.
Annál is inkább, mert nem teljesen triviális, hogy miért nem veszélyes (pontosabban elhanyagolhatóan veszélyes) a rák szempontjából a vérátömlesztés, illetve a természet nagy törvénye, hogy ami lehetséges, az - időnként - meg is történik, márpedig a "ragályos rák" lehetséges is, illetve időnként meg is figyelhető. De menjünk szép sorban.
A rák gyilkos természete pont abban rejlik, hogy a szervezet saját sejtjei válnak kvázi pszichopata, csak saját osztódásaikra koncentráló egységekké. Márpedig, mivel az "ellenség" belülről jön, az általában külső "ellenség" felkutatására szakosodott immunrendszer sokkal nehezebben tud a dologgal megbirkózni. (Nem véletlen, hogy a 2013-ban már az Év Áttörésének megválasztott rák-immunterápia kifejlesztése évtizedekig tartott.)
Az immunsejtek érésük során a csecsemőmirigyben (tímusz) hosszas szelekciós lépéseken mennek keresztül, egyrészt, hogy felismerjék azokat a sejtfelszíni molekulákat (MHC-I/HLA), amelyek révén a szervezet sejtjei "bemutatják" a bennük található fehérjék darabkáit, így az esetleges patogéneket is ("pozitív szelekció"), másrészt, hogy ha a sejtek csak normális fehérjéket mutatnak be, ne aktiválódjanak ("negatív szelekció").
Ennek köszönhetően a tímuszból kikerülő immunsejtek már nagy hatékonysággal képesek a sajátot a nem sajáttól megkülönböztetni, ami a korábban említett patogén-válasz mellett a kilökődési reakciók alapját is képezi: hiszen így ismeri fel az immunsejt, mi az ami saját és mi az ami nem (és ezért kell annyira gondosan megválogatni a donorokat a transzplantációk esetében). És bizony, a rákos sejtek ezen a szűrőn általában fennakadnak. Általában, de azt mint alább néhány állati és emberi példa mutatja majd, nem mindig.
Emlősök között két jól ismert formája is van a "ragályos tumoroknak", az egyik az ausztráliai tasmán ördög populációkat tizedelő DFTD (Devial Facial Tumor Disease) - amiről korábban is írtunk -, a másik pedig a kutyák jóval enyhébb Sticker-szarkómát okozó megbetegedése, a CTVT (Canine Transmissible Venereal Tumor).
Ezek mellé "zárkózott" fel a napokban egy nagyon más állatcsoportot érintő, de hasonló logikával működő megbetegedés, az Egyesült Államok keleti partja mentén levő kagylópopulációkat érintő leukémia.
A Mya arenaria nevű, puha héjjú kagylókat írintő kór azzal jár, hogy a kagylók hemolimfájában egy fura alakú, aneuploid sejtpopuláció jelenik meg és kezd el nyakló nélkül szaporodni (lásd alább a C panelen). (Természetesen a kagyló és a gerincesek keringése közt jelentős különbség van, de a "leukémia" logikája - egy adott sejtpopuláció felszaporodása - ugyanaz.)
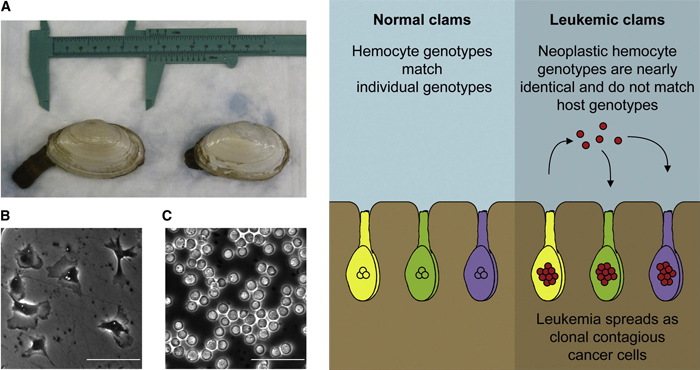
Korábban is voltak arról sejtések, hogy ez egy ragályos betegség lehet, hiszen mesterséges környezetben már volt rá példa, hogy beteg hemociták segítségével egyébként egészséges kagylókat megbetegítettek, de hogy ez mennyire játszódhat le tengervízben, azt eddig senki nem tudta pontosan.
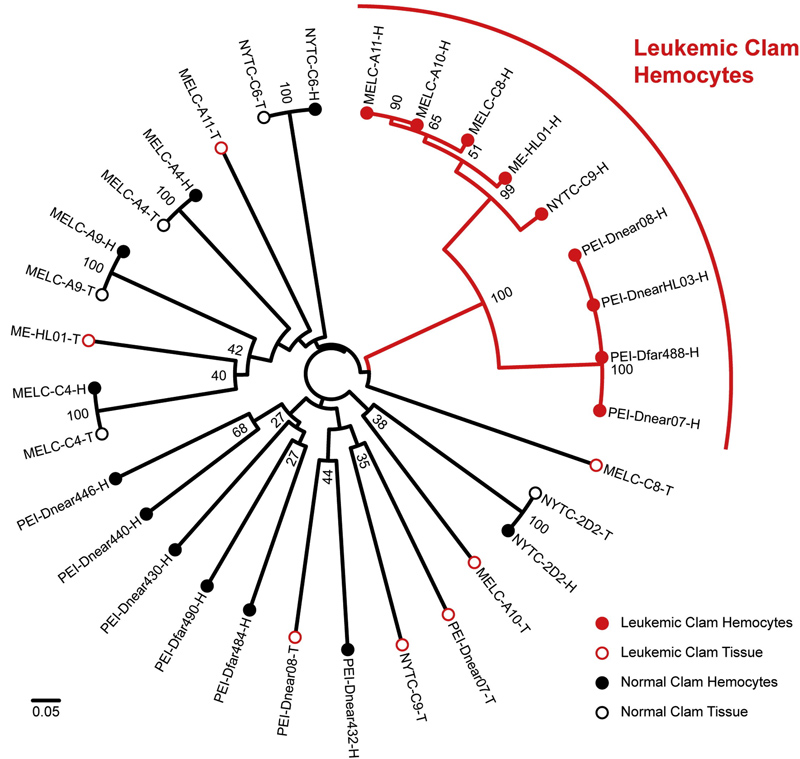 Pár hete a Cell-ben megjelent tanulmány járt aztán ennek pontosabban utána: egészséges és beteg kagylók hemocitáinak genetikai profilját vetették össze az állatok egyéb szöveteivel, és elég egyértelmű eredményekre jutottak:
Pár hete a Cell-ben megjelent tanulmány járt aztán ennek pontosabban utána: egészséges és beteg kagylók hemocitáinak genetikai profilját vetették össze az állatok egyéb szöveteivel, és elég egyértelmű eredményekre jutottak:
míg az egészséges kagylók esetében a hemociták és egyéb szövetek profilja megegyezett (ahogy az várható volt), addig a beteg kagylók esetében a két szövettípus élesen eltérő genetikai profilt mutatott.
Sőt, a beteg kagylók hemocitái egymáshoz nagyon-nagyon hasonlítottak, jól mutatva, hogy minden valószínűség szerint egy klónális populáció növekedése révén jöttek létre, vagyis a kagyló leukémia ragályos, és a vízáramba kikerülő beteg hemociták egész tisztességes távolságokat képesek bejárni, hogy egy új gazdában megtelepedjenek. (Mivel a kagylók egyébként is szűrögetik a környezetüket, valószínűleg, ha már egy másik kagyló közelébe kerül, a sejtnek viszonylag könnyű dolga lehet az új gazda megfertőzésében.)
Vagyis a DFTD és CTVT mellett immár van egy harmadik, jól dokumentált "állatvilágos" példánk is a malignus sejtek potenciális ragályosságára.
De mi lesz az immunrendszerrel, miért nem ismeri fel a betolakodó, beteg sejteket? A kérdés most természetesen nem a kagyló-leukémiára vonatkozik, hiszen a puhatestűeknek nincs a mienkéhez hasonló adaptív immunrendszere, hanem az elején említett két emlős példára.
Mint kiderült, mindkét esetben arról van szó, hogy a rákos sejtek megtanultak rejtőzködni, azáltal, hogy az MHC-I fehérjéiket kódoló géneket elcsendesítik, így "kevésbé lesznek szem előtt", az immunrendszer szempontjából nézve. Persze teljesen kikapcsolni nem tudják ezeket a géneket, mert azt szintén "gyanúsnak" ismerné fel a szervezet - az MHC-I fehérjéket minden sejt kifejezi a felszínén), és a természetes ölősejtek (Natural Killer - NK) végeznének fel velük. Valószínűleg ez - vagyis, hogy nem tud teljesen ebújni az idegen tumorsejt - vezet ahhoz is, hogy nagyon kevés kivételtől eltekintve a CTVT nem fatális, előbb-utóbb az immunrendszer kiszúrja és elpusztítja a betolakodókat és kutyák felgyógyulnak, közben egy életre szóló CTVT-ellenes védelmet is szerezve. (A tasmán ördögök esetében pedig valószínűleg azért nem ennyire pozitív a végkifejlet, mert a létező populációk kicsik és nagyon beltenyésztettek, így az idegen sejtek genetikai profilja is nagyon közeli lesz a gazdájéhoz.)
És akkor végül innen el is juthatunk a kevés ismert emberi példához is. Egyes esetekben, mint amikor szervátültetés után jelenik meg a rák (mivel a donor maga is beteg volt), a magyarázat nagyon is kézenfekvő: az eleve immunszupresszió alatt levő szervezetben könnyebben tud fennmaradni a káros populáció is. De van (legalább) két sokkal kevésbé hétköznapi, de jól dokumentált történet is, amikor immunszupresszióról, a szó modern, orvosi értelmében nem lehet szó, mégis, bizonyíthatóan "ragályos" volt a daganat. Mindkét történetben a betegség terhes anyákban jelent meg és onnan került át a magzataikra, ráadásul mindkét eset Japánban lett dokumentálva. (Megj.: természetesen szinte biztosan kijelenthető, hogy még sok hasonló ilyen eset lehetett - bő tucatnyitra van utalás a szakirodalomban is -, de ez a kettő lett csak megfelelően dokumentálva.)
 Az egyik esetben egy nyolc hónapos kisfiú bal heréjében fedeztek fel egy furcsa duzzanatot, amit a kórházban tumorként diagnosztizáltak, és ezért a herét el is távolították. A tumort Epstein-Barr vírus (EBV) okozta NK/T-sejtes limfómaként diagnosztizálták, ami egy nagyon-nagyon ritka betegség gyerekekben. Ez önmagában is megrázó történet lenne, de mivel a gyerek anyját, a terhesség hetedik hónapjában, szintén EBV-okozta NK/T-sejtes limfómával szállították kórházba, felmerült, hogy nincs-e a két betegségnek köze egymáshoz. (A gyerek végül császármetszéssel született, az anyát viszont nem sikerült megmenteni.)
Az egyik esetben egy nyolc hónapos kisfiú bal heréjében fedeztek fel egy furcsa duzzanatot, amit a kórházban tumorként diagnosztizáltak, és ezért a herét el is távolították. A tumort Epstein-Barr vírus (EBV) okozta NK/T-sejtes limfómaként diagnosztizálták, ami egy nagyon-nagyon ritka betegség gyerekekben. Ez önmagában is megrázó történet lenne, de mivel a gyerek anyját, a terhesség hetedik hónapjában, szintén EBV-okozta NK/T-sejtes limfómával szállították kórházba, felmerült, hogy nincs-e a két betegségnek köze egymáshoz. (A gyerek végül császármetszéssel született, az anyát viszont nem sikerült megmenteni.)
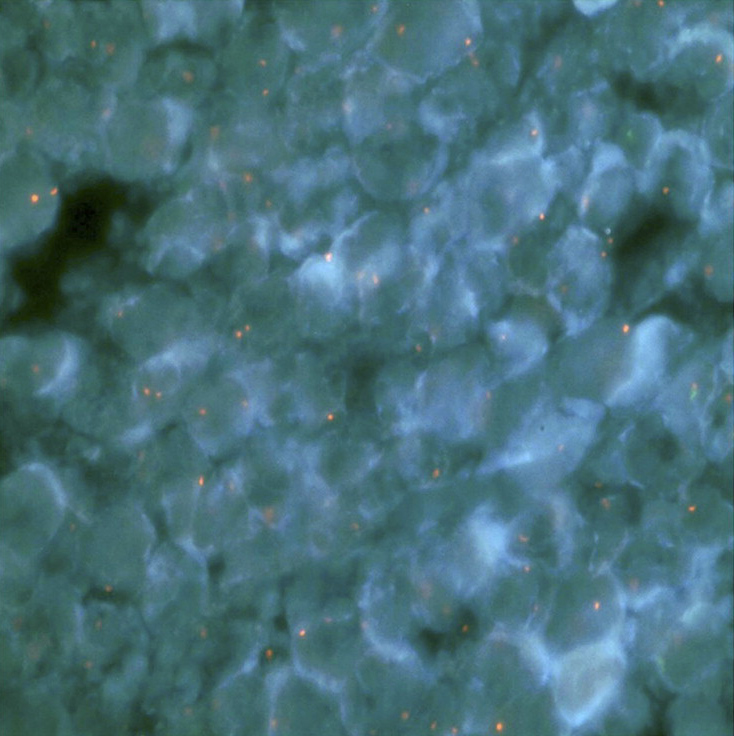
Mivel a kisfiú hereszövetében egyszerű immunfestéssel is ki lehettt mutatni, hogy számos olyan sejt található, amiben két X kromoszóma van (a bal oldali ábrán két piros pötty, egy piros és egy zöld helyett), eleve nagyon valószínűnek tűnt, hogy erről van szó, és később további DNS-elemzések ezt meg is erősítették: bár a kisgyerek normális sejtjei egyaránt tartalmaztak az apától és az anyától jövő genetikai anyagot, a dagantban csak anyai DNS van.
A másik esetben, egy normális lefolyású szülés csak hónapok múlva fordult tragédiába: három hónappal a szülés után az anyát leukémiával szállították a kórházba, ahol már nem tudták megmenteni. A kislányában pedig bő fél évvel később, 11 hónapos korában diagnosztizáltak egy állkapocs-daganatot. Mivel a két betegség egy teljesen megegyező genetikai átrendeződés következtében jött létre (a BCR és ABL1 gének fura fúziója jelent meg), itt is felmerült, hogy közös okkal állunk szemben. Az igazolás nagyobb részt hasonló volt (kiderült, hogy a daganatos sejtek csak anyai markereket fejeznek ki, apaiakat nem), ráadásul a kutatóknak sikerült arra is választ adniuk, hogy miként tudtak elbújni az anya sejtjei a gyerek immunrendszere elől. (Ez egyáltalán nem triviális probléma, és például terhesség közben, amikor két rokon, de nem teljesen megegyező szervezet van nagyon intim kapcsolatban egymással, a méhlepény magzati oldalán levő sejtek mindenféle trükköket vetnek be, hogy az anyai szervezet ne ismerje fel őket idegenként.)
A rosszindulatú BCR-ABL1 fúzió mellett ezek a sejtek egy másik mutációt is hordoztak, amelyek révén pont azokat az anyai MHC-I/HLA génjeiket elvesztették, amelyeket a gyerek nem örökölt. Azaz, a kislány immunrendszere tulajdonképpen nem tudta idegenként felismerni ezeket a sejteket és azok így viszonylag zavartalanul létrehozhattak egy daganatot. Ennek az esélye, különösen a BCR-ABL1 kapcsolódással egyetemben szinte elenyésző volt, de mégis bekövetkezett.
A fenti esetek ritkasága és különlegessége mutatja, hogy miért szinte elenyészően kicsi az esélye a Vágó által felvetett problémának. Ugyanakkor a természet fura utait ismerve, a nagy számok törvénye alapján nem lehet kizárni, hogy egy nem nulla valószínűségű esemény előbb-utóbb bekövetkezik...
Metzger MJ, Reinisch C, Sherry J, Goff SP (2015) Horizontal transmission of clonal cancer cells causes leukemia in soft-shell clams. Cell 161(2): 255-63.
Isoda T, Ford AM, Tomizawa D, van Delft FW, De Castro DG, et al. (2009) Immunologically silent cancer clone transmission from mother to offspring. PNAS 106(42): 17882-5.
Yagasaki H, Ohashi H, Ito M, Kobayashi S, Kato M,et al. (2011) A novel mechanism of transplacental cancer transmission: natural killer/T-cell lymphoma in the paratesticular region is of maternal origin. Blood 117(22): 6046-7.
Welsh JS (2011) Contagious Cancer. The Oncologist 16(1):1-4.
Belov K (2012) Contagious cancer: lessons from the devil and the dog. Bioessays 34(4): 285-92.