Amikor öt hét után hazavihették az inkubátorból koraszülött kisfiukat, Phoenix Wilkinson szülei azt hitték, a nehezén már túl vannak. Tévedtek, az igazi gondok csak otthon kezdődtek: a csecsemő súlya nem gyarapodott és testét folyamatosan kiütések borították. Hetekbe telt és konzultációk tucatjaiba, amíg végül egy kaliforniai orvos rájött, mi is áll mindennek a hátterében - a gyerek egy súlyos, kombinált immundefektus (SCID - Severe Combined Immunodeficiency) nevű szindróma áldozata volt, ami nem sok jóval kecsegtetett a jövőre nézve.
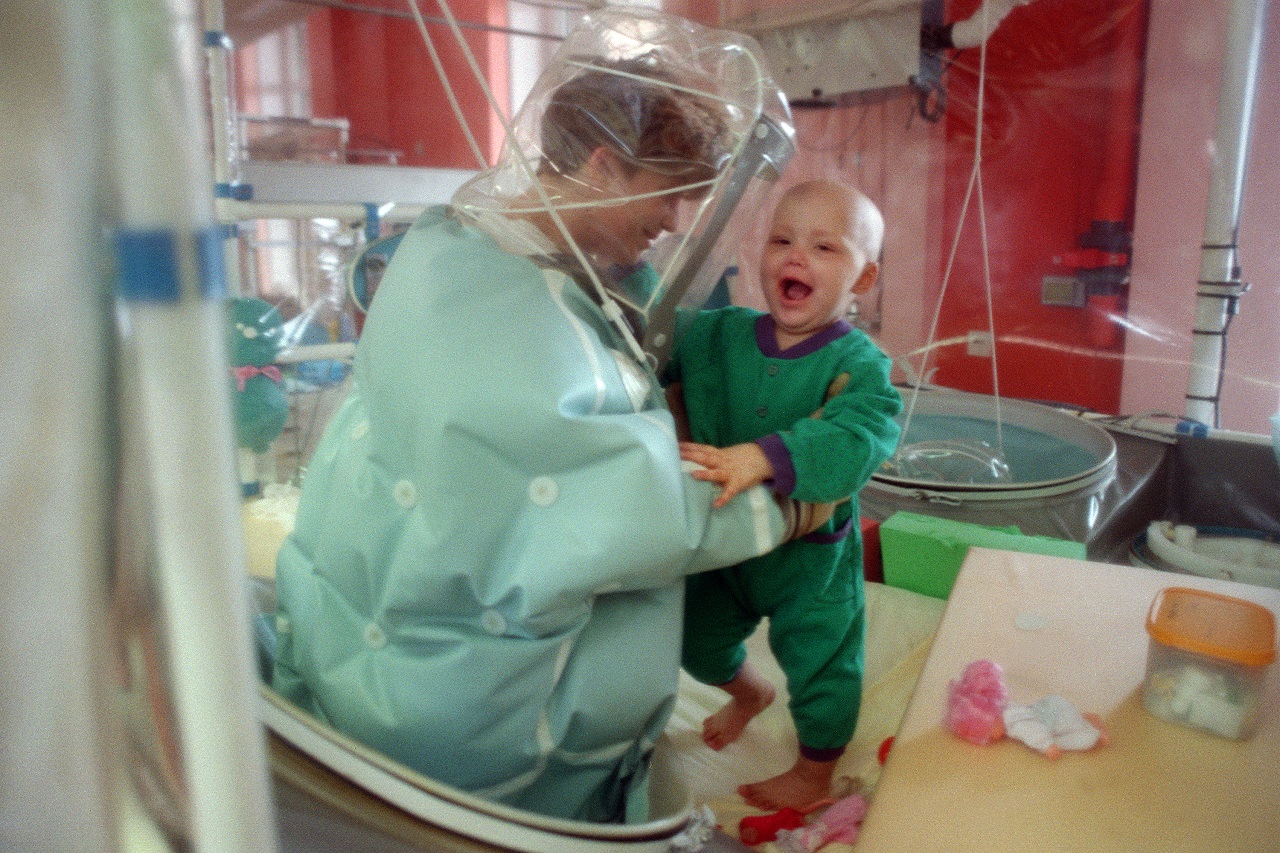
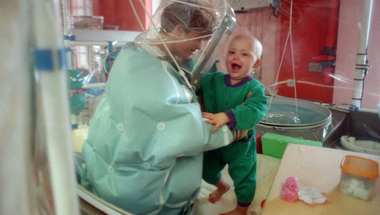
- Kombinált immundefektus szindrómával küzdő kisgyerek a franciaországi Lyon egyik kórházában. Itt az elsők között kísérleteztek génterápiával a szindróma kezelésében. (AFP)
A SCID-beteg gyerekek immunsejtjei (pontosabban B- és T-sejtjei) működésképtelenek, amelyek miatt igen fogékonyak a különböző betegségekre, ezért különösen védett körülményeket igényelnek - innen ered a populáris irodalomban jobban elterjedt "buborék gyerek szindróma" kifejezés is. A kezelés legbeváltabb módja a kemoterápiát követő csontvelő-átültetés, amely után a csontvelői eredetű sejtek (így az immunsejtek is) újra tudnak képződni a beültetett csontvelői vérképző őssejtek segítségével. A gond csak a megfelelő donor megtalálásával lehet, hiszen nem mindig könnyű nagyon-nagyon hasonló szöveteket találni (és nem megfelelő donor szöveteit átültetve akár halálos kilökődési reakció is felléphet).
Épp ezért vetették fel az utóbbi időben egyre többen, hogy ilyen helyzetekben talán nem is kellene a donor keresésével vesztegetni az időt, hanem a SCID-betegek esetében a saját vérképző őssejtjeikben kellene kijavítani a SCID kialakulását előidéző mutációt, majd ezeket a "javított" sejteket visszaültetve fel sem merülhet a kilökődés veszélye.
Minderre azért van lehetőség, mert az úgynevezett genomszerkesztési technológiák segítségével egyre egyszerűbben (és nem mellesleg pontosabban) tudunk belenyúlni a legkülönbözőbb szervezetek genetikai állományába.
ZFN, TALEN, CRISPR - a legmodernebb technológiák rövidítései néha tényleg arra emlékeztetnek, mintha összeolvasnánk a betűtésztás zacskóból az asztalra kihulló betűket. Ezekben a különféle genomszerkesztő technológiákban az a közös, hogy valamilyen módon a genom egy (általunk) nagyon jól meghatározott pontjához szállítanak olyan enzimeket (ún. nukleázokat), amelyek hasítják a DNS-t. A ZFN és TALEN alapú technológiák ehhez a célbajuttatáshoz kizárólag DNS-kötő fehérjéket használnak, míg a bakteriális sejtek fágok elleni védekezési mechanizmusából adoptált CRISPR esetében a cél felismerését egy RNS molekula végzi.
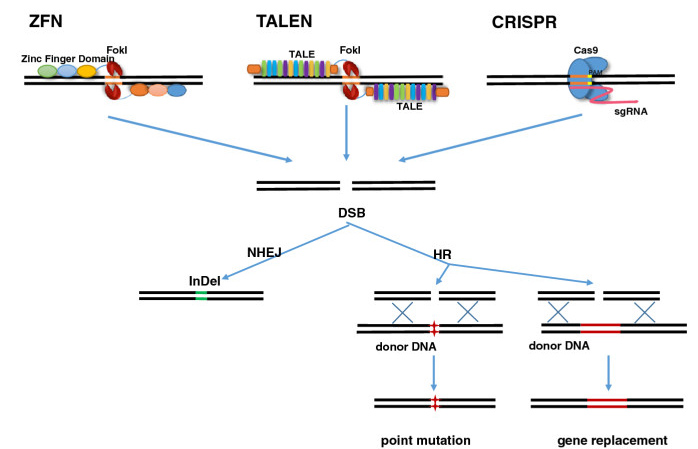
- A legelterjedtebb genom-hasítási eljárások működési elve, és a DNS hibajavítás lehetséges eredményei. (via GigaScience)
Az egészséges sejtben a DNS nem töredezett, így az elhasított, kettősszálú DNS a sejten belül hibát jelez, és ezt észlelve a sejt bekapcsolja hibajavító mechanizmusait. A javítás során vagy egyszerűen összekapcsolódik a két egymához közeli DNS vég (ezt nevezi a szakirodalom zsargonja Non-Homologous End Joiningnak - NHEJ), vagy a sejten belüli javító mechanizmusok egy, a hasítás helye körüli szekvenciákat hordozó DNS darabot - optimális esetben a gén másik, sértetlen allélját - használva templátként, ún. homológ rekombinációval (HR) foltozzák be a lyukat.
Számos genom-szerkesztő eljárás az utóbbi jelenséget használja ki, az eredetitől kicsit eltérő szekvenciájú DNS darabot adva másolási templátként, és így a javítás végére az utóbbin jelen levő bázissorend köszön vissza a genomból is. Ez pedig azt jelenti, hogy ha SCID-pozitív sejtekben, a mutáció helyén hasítva, majd egy mesterséges, mutációt nem hordozó "minta" DNS darabot segítségül hívva, kijavítható a hiba. Persze ez a logika mindenféle más olyan betegség esetében is használható, ahol a hiba a vérképző őssejt valamelyik utódsejtjében jelentkezik, így a sarlósejtes vérszegénység, amelynek géneditálás alapú kijavításán már dolgozik egy stanfordi labor.
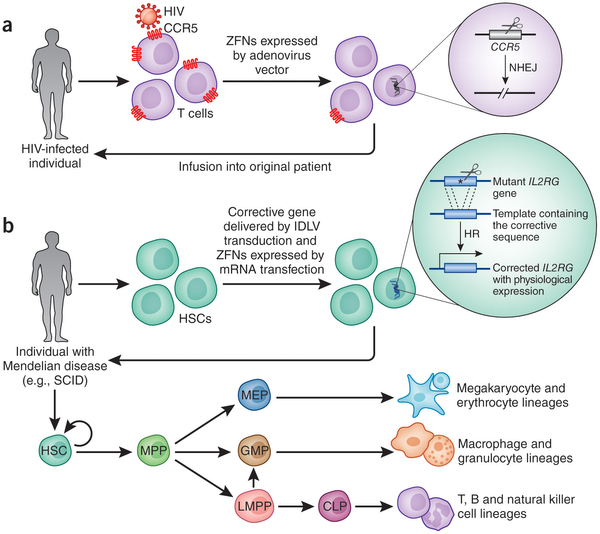
- A vérképző őssejteket célzó, genom-szerkesztésen alapuló génterápiás eljárások összefoglalója. (via Nature)
Az elsősorban másolási templát hiányában bekövetkező NHEJ nagy gyakorisággal a megcélzott gén működésképtelenségét okozhatja, így a fenti logikával ellentétben az már kicsit kontraintuitívnek tűnhet, hogy ezt is használhatjuk terápiás céllal. Az egyik lehetőség, ami például az AIDS elleni küzdelemben lehet fontos, hogy a HIV vírus otthonául szolgáló T-sejtek felszínéről eltüntethetjük azt a sejtfelszíni molekulát, név szerint egy kemokin-receptort, a CCR5-öt, ami a vírus megkötését is végzi. A CCR5 jelenléte nem létfontosságú, és hiányában egy HIV-hordozó személy testében a vírus koncentráció hamar csökkenni kezdene.
A CCR5 egyébként nem az egyetlen receptor, ami génterápiás beavatkozás célpontja lehet: pár hete, januárban írtak le egy furcsa esetet a Cell-ben, amikor egy WHIM-szindrómás hölgyben spontán gyógyulást észleltek. A WHIM egy CXCR4 nevű kemokin-receptor mutációjából ered és a gyógyulás mögött - mindenki legnagyobb meglepetésére - az állt, hogy egy spontán kromoszómaátrendeződés miatt, a gén (mutációstól) elveszett a vérképző őssejtekben. Márpedig ez tipikusan olyan mutáció, amit ma már mi is indukálni tudnánk a genom-szerkesztő eljárásokkal.
Bár ezekben a kísérletekben aktívan átírnánk az emberi genom egy kis darabját (gyakran csak javítva, amit a természet spontán elrontott), valószínű, hogy nem ütköznek majd nagy társadalmi ellenállásba, hiszen ki ne értene egyet azzal, hogy egy SCID-szindrómás vagy HIV-pozitív kisgyereknek megadjuk az esélyt a boldogabb élethez. Ráadásul itt minden esetben testi sejteket használnánk, vagyis a mutáció nem lenne örökíthető.
A bonyodalmak ott kezdődnek, hogy a technológia arra is tökéletesen alkalmas, hogy az ivarsejtek genomját megváltoztassuk.
Márpedig ez utóbbi etikai szempontból igazi aknamezőnek tűnik. Hiszen egyből felmerül a "dizájner bébik" gyakran megidézett szelleme, vagyis (ahogy az gyakran megfogalmazódik) a gazdag családok kék szemű, jó vágású, nagyon okos gyereket "készíttethetnének" maguknak. Vagy a maradi géndopping helyet a sportelsőségre hajtó csapatok/államok olyan atlétákat "tenyészthetnének", akik sokkal jobban teljesítenek. És bár ezen félelmek egy része jelenleg nem túl megalapozott (még mindig nagyon-nagyon keveset tudunk nemcsak az intelligencia genetikai hátteréről, de még az olyan hétköznapi dologról is mint a testmagasság), mint azt az Ázsiában mesterségesen eltolt nemi-arány is mutatja, valóban emberek tömegeiben létezik vágy arra, hogy utódaik tulajdonságait az általuk ideálisnak vélt irányba megváltoztassák.
Praktikusabb veszélynek tűnik, hogy bár a genom-szerkesztési technikák (különösen a CRISPR) jelenleg nagyon specifikusnak tűnnek, minden egyes "szerkesztés" magával hordozza annak a veszélyét, hogy nem csak a kívánt helyen hasít majd a nukleáz, hanem a genom egy másik pontján is létrehoz egy nem kívánt DNS törés-mutáció ciklust. Ez etikailag is problematikussá teszi, hogy a beavatkozás mennyire kivitelezhető, mennyire használhatnánk embereket kísérleti nyúlként.
Ráadásul jelenleg a CRISPR adoptálás egyik legfőbb helyszínének számító Amerikában is szinte univerzális elutasítást élvez, az esztétikai célú, vagy intelligencia-javítást célzó génmódosítás - szemben például a terápiás célú beavatkozással, ahol a társadalom már lényegesen megosztottabb képet mutat.
Ennek részben az az oka, hogy sokak szerint ha már az olyan testi őssejtekben, minta vérképző őssejtek, kijavítjuk a SCID-hez hasonló betegségeket okozó mutációkat, miért ne tennénk meg ezt úgy, hogy ez a változás ne csak a kezelt személyben, hanem utódjaiban is jelen legyen, lehessen, vagyis egy bizonyos sejtpopuláció helyett minden sejtet érintsen? Az esetleges nem-kívánt mutációkat, mondják az elgondolás védelmezői, szűrni lehetne, ugyanazokkal a technológiákkal, amelyeket ma a mesterségesen megtermékenyített (IVF) embrióknál használunk.
Pont ez a szűrési-lehetőség azonban az, amibe sok ellenző is belekapaszkodik: minek az egész genomeditálási herce-hurca, ha egyszer az embriókat egyébként is lehetne szűrni, hogy betegek lesznek-e vagy sem? A végső eredmény (egy egészséges gyerek) nem ugyanaz lenne-e?
Ha ezt az érvelést elfogadjuk, akkor hirtelen öncélúnak tűnhet sok támogató érv, ugyanakkor kétségtelen, vannak bizonyos esetek, amikor ez nem működne. Konkrétan, ha a leendő szülők olyan mutációkat hordoznak, amelyek következtében ivarsejtjeik nem lesznek működőképesek, azt nehéz lenne másképp kikerülni, mint a mutációk kijavítása után in vitro (azaz laboratóriumi körülmények között) rábírni a sejtjeiket, hogy működőképes ivarsejteket hozzanak létre (viszont ezáltal örökletes változásokat hozva létre).
Mivel a CRISPR-alapú genomszerkesztés eddig minden egyes vizsgált fajban remekül működött (beleértve majmokban is, egy tavaly januári cikk tanúsága szerint, illetve emberi eredetű sejtvonalakban), azt kevesen kérdőjelezik meg, hogy a technológia bevethető emberi embriókban is.
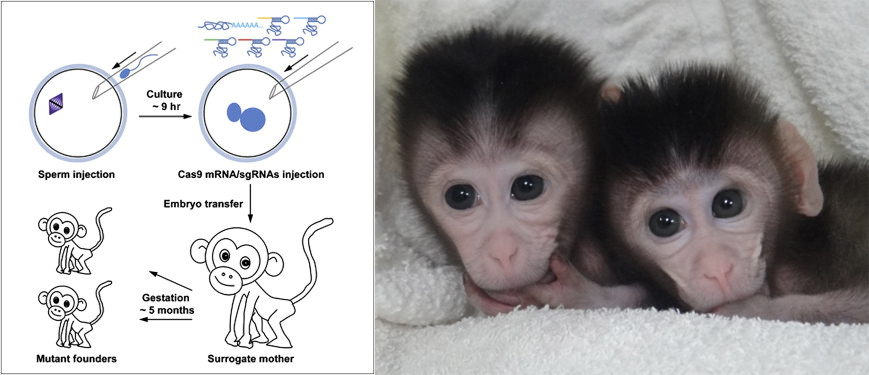
- A génmódosított majmok létrehozását célzó kísérlet vázlata (balra) és eredményei, a makákó ikrek. (via Cell)
Sőt, bár jelenleg a legtöbb (főleg európai) ország kifejezetten tiltja az emberi embriókon való kísérletezést, több IVF-re specializálódott cég is érdeklődik a téma iránt, ráadásul a szakmában keringő pletykák szerint, mind az IVF embriókon történő módosítás, mind a csíravonal(kezdeményben) való beavatkozás tulajdonképpen már meg is történt.
Előbbi valahol Kínában (hol máshol) és állítólag az erről beszámoló cikk(ek) már elbírálás alatt van(nak). Utóbbi pedig, az Independent beszámolója szerint, a Harvardon, George Church laborjában történhetett (ami tulajdonképpen nem meglepő, hiszen Church az, aki manapság a legnagyobbat mer álmodni, ha genomszerkesztés szóba kerül, legyen szó mamut feltámasztásról, vagy mesterséges genetikai kódot hordozó baktériumokról). Churchék, ha hiszünk az Independent cikkének (ami persze még messze nem ugyanaz, mint egy igazi szakcikk), őspetesejtekben javították ki a mell- és petefészekrák kockázatát jelentősen megnövelő BRCA1 mutációt (valami hasonlót mint ami miatt Angelina Jolie nemrég több műtétnek vetette alá magát, hogy a kockázatos szöveteket eltávolítsa).
Az események ilyen felgyorsulása mellett nem véletlen, hogy az elmúlt napokban mind a Nature, mind a Science, napjaink két legrangosabb tudományos magazinja, olyan véleménycikkeket közölt, amelyek egyrészt legalább ideiglenes moratóriumot hirdetnének az emberi embriókon végzett kísérletek terén, másrészt a társadalmi vita beindítását is célozzák.
A cikkeket egy januárban, a kaliforniai Napa-ban tartott összejövetel ihlette, ahol a genomszerkesztés úttörői (köztük Church is) ültek össze megvitatni, hogy mi az, ami jelenleg lehetséges, mi az ami jelenleg kívánatos, és főképp mi az, amit tisztázni kell, mielőtt - főleg az embert érintő kísérletekkel - tovább lépne a tudományos közösség. A klasszikus követendő példa az 1975-ben, egy másik kaliforniai helyszínen, Asilomarban tartott konferencia, amelyet a DNS-t hasító restrikciós enzimek felfedezése után tartottak, amikor nyilvánvalóvá vált, hogy hamarosan szinte tetszőleges DNS-darabokat össze lehet kapcsolni. Az ott elfogadott ideiglenes moratórium elősegítette, hogy a kutatók jobban megismerjék a rekombináns DNS tulajdonságait, megvizsgálják esetleges kockázatait, és abszolút nem mellesleg a társadalom is nyitottabb legyen, hiszen a kutatók láthatóan felelősségteljesen viselkedtek. Most is erre lenne nagy szükség.
(via Independent, KQED, Nature News, Technology Review)
[A poszt eredetileg a Science Meetup blogjában jelent meg.]
Cox DB, Platt RJ, Zhang F (2015) Therapeutic genome editing: prospects and challenges. Nat Med 21(2):121-31.
Lanphier E, Urnov F, Haecker SE, Werner M, Smolenski J (2015) Don't edit the human germ line. Nature 519(7544):410-1.
Baltimore D, Berg P, Botchan M, Carroll D, Charo RA,etal. (2015) A prudent path forward for genomic engineering and germline gene modification. Science 348(6230):36-8.