 Általában ha rekombináns fehérjetermelésről esik szó, mindenki baktériumokban, élesztőkben, sejtvonalakban gondolkodik, de ezeknél sokkal kevésbé ismert rendszerek is léteznek, a saját előnyeikkel. Az alapprobléma mindenütt ugyanaz, egy csomó gyógyszerként vagy ipari adalékként használható fehérjét ismerünk, azonban ezek megtermeltetése általában elég drága. A ma ismertetett rendszer ezen próbálna segíteni, egy rovar alapú expressziós rendszerrel.
Általában ha rekombináns fehérjetermelésről esik szó, mindenki baktériumokban, élesztőkben, sejtvonalakban gondolkodik, de ezeknél sokkal kevésbé ismert rendszerek is léteznek, a saját előnyeikkel. Az alapprobléma mindenütt ugyanaz, egy csomó gyógyszerként vagy ipari adalékként használható fehérjét ismerünk, azonban ezek megtermeltetése általában elég drága. A ma ismertetett rendszer ezen próbálna segíteni, egy rovar alapú expressziós rendszerrel.
A selyemhernyó elég régen háziasított állat, eddig is fehérjetermelésre használták, mivel a selyem maga fehérjetermészetű, a szál háromnegyedét a vízben nem oldódó rostos fehérjemag alkotja, a negyedét viszont a szálat borító ragacsos szericin fehérjék. Ezek a szállal ellentétben vízben oldhatóak, így egyáltalán nem őrültség a szericintermelő mirigyekben termeltetni rekombináns fehérjéket, amelyek így a szelyemszál bevonatába kerülnek, majd arról egyszerűen lemoshatóak.
Ezt a rendszert használva kipróbálták, nyereségesen termelhető -e rekombináns emberi szérum albumin? Ez a fehérje ugyanis a gyógyászatban is használatos, méghozzá óriási adagokban, egyszerre tíz gramm is kell belőle, ellenben jelenleg emberi vérből nyerik ki, ami nyilván fertőzésveszélyes.
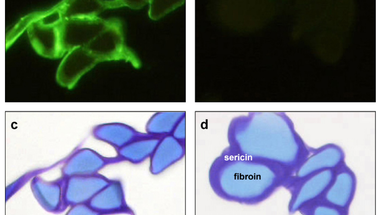
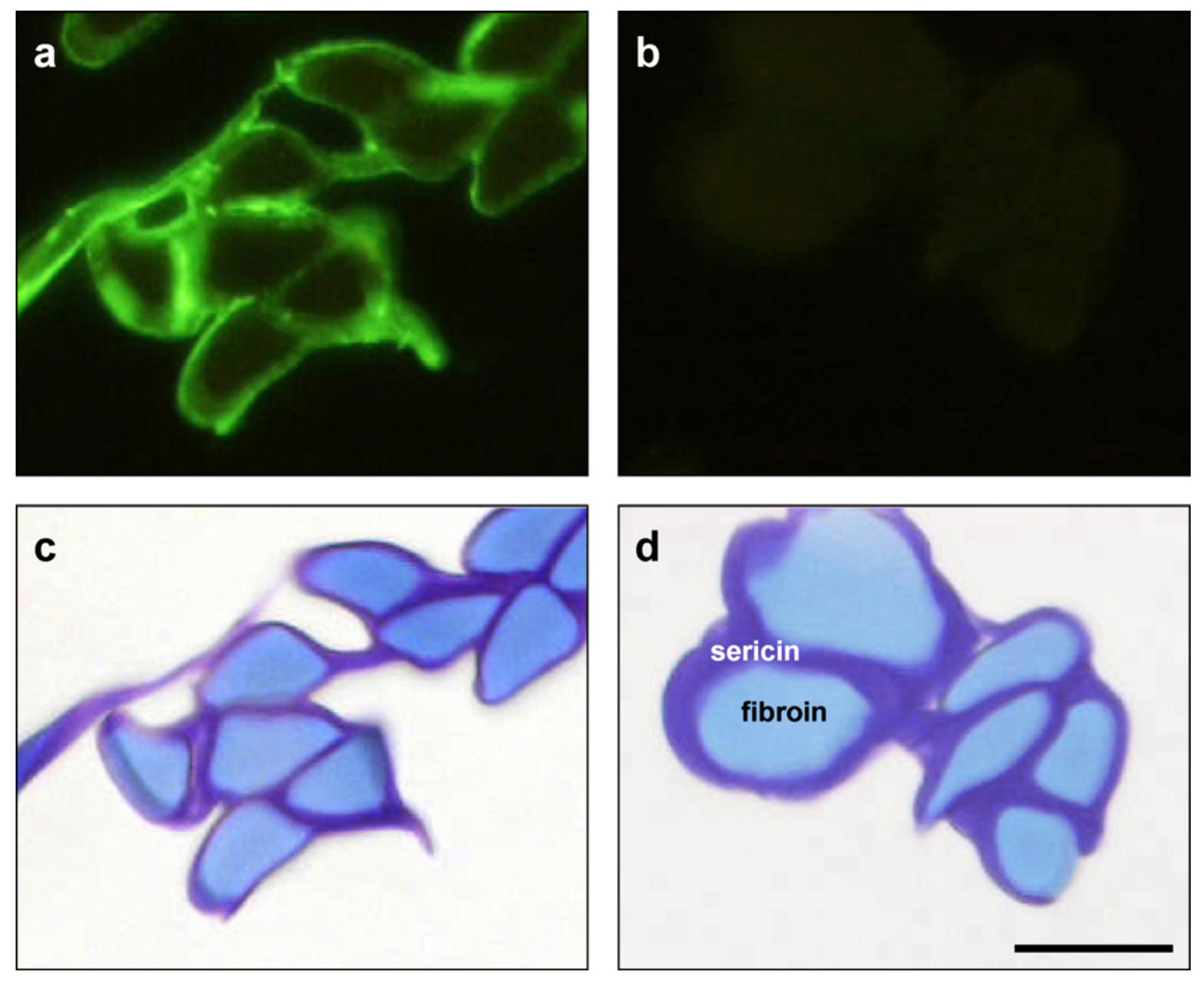
Selyemlepkébe klónozták az emberi szérum albumin génjét, majd megnézték, a selyemgubókban kimutatható -e a termelőd albumin. Nem meglepő módon igen, egy emberi albumint felismerő ellenanyaggal zölddel megfesthető a termelődő szérum albumin fehérje, ami így a transzgénikus (első A ábra) selyemlepke gubójából kimutatható, a vad típusúéból nem (első B ábra), de ettől a selyemfehérjék eloszlása cseppet sem változik (Első C és D ábra). A termelt fehérje mennyiségét is megbecsülték, körülbelül hat miligramm emberi szérum albumin található két gramm selyemgubóban, egy egyszerű három lépéses kivonással ennek a felét ki is tudják nyerni a gubóból.
Egy negyedik közleményben azt írják le, hogy emberi inzulin-szerű növekedési faktort (hIGF-I) termeltettek selyemhernyókban. Ez a fehérje a cukoranyagcserére gyakorol hatást, az I. típusú cukorbetegek vércukorszintjét is csökkenti és ami elég szokatlan, a bélcsatornából is felszívódik, nem kell injekcióban adni, szájon át is bevehető. A hIGF-I génje ismert, nyilván bejuttatták a selyemlepke genomjába és megnézték, ellenőrizték, hogy termeli az emberi hormont, majd ellenőrizték működik -e a termelt hormon. Selyemhernyók szövőmirigyeit egyszerűen kivágták, majd porították és egerekkel etették meg, akinek ettől a kezeléstől csökkent a vércukorszintjük.
Egy frissebb közleményben gyakorlatilag ugyanebben a rendszerben emberi adiponektint termeltettek. Az adiponektin növeli az inzulinérzékenységet, így a cukorbetegség kezelésében lehet fontos szerepe. Az emberi adiponektin gént egy vektorba klónozták, majd egy ugráló genetikai elemen juttatták a selyemlepke genomba. Nem meglepő módon a lepkék megtermelték az emberi fehérjét, itt vége is a cikknek, eddig nem közöltek le erről semmilyen komolyabb vizsgálatot sem.
A transzgénikus selyemhernyó egy alighanem elég kevéssé ismert fehérjetermelő rendszer, de azért találni arra is példát, hogy a gyógyászatban fontos molekulák is megtermeltethetőek bennük.
Shin, S., Kim, B. Y., Jeon, H. Y., Lee, A., Lee, S., Sung, S. H., ... & Kim, K. (2013). Expression system for production of bioactive compounds, recombinant human adiponectin, in the silk glands of transgenic silkworms. Archives of pharmacal research, 1-7.
Ogawa, S., Tomita, M., Shimizu, K., & Yoshizato, K. (2007). Generation of a transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon: production of recombinant human serum albumin. Journal of biotechnology, 128(3), 531-544.
Shin, S., Kim, B. Y., Jeon, H. Y., Lee, A., Lee, S., Sung, S. H., ... & Kim, K. (2013). Expression system for production of bioactive compounds, recombinant human adiponectin, in the silk glands of transgenic silkworms. Archives of pharmacal research, 1-7.
Cong, L., Cao, G., Renyu, X., Zhonghua, P., Xiaojian, Z., Zhou, W., & Gong, C. (2011). Reducing blood glucose level in TIDM mice by orally administering the silk glands of transgenic hIGF-I silkworms. Biochemical and biophysical research communications, 410(4), 721-725.