Április 25-én volt pontosan hatvan éve, hogy James Watson és Francis Crick leközölte a Nature című folyóiratban a dezoxiribonukleinsav (DNS) általuk elképzelt szerkezetét [1]. A két kutató pálcikákból és lapokból álló modelleket készített kollégáik eredményei és elgondolásai alapján. Maurice Wilkins és Rosalind Franklin az 1950-es évek elején DNS szálakról készített nagy felbontású röntgendiffrakciós képei azt sugallták, hogy az spirál alakú és nem csak egy szálból áll. Alexander Todd szerves kémiai laboratóriumában 1952-ben kimutatták, hogy a dezoxiribonukleotidokat 3’-5’ foszfodiészter kötés tartja össze. Linus Pauling 1951-es alfa hélix fehérjeszerkezeti felfedezése alapján pedig William Cochran, Francis Crick és Vladimir Vand kidolgozott egy elméletet a hélix szerkezetű molekulák diffrakciójáról. Ezek alapján jutott el végül is Watson és Crick a már ismert kettős hélix modellig, mely sztereokémiailag a legmegfelelőbb választ adta arra, hogy a röntgendiffrakciós kép milyen szerkezetnek felelhet meg. A modell alapján két egymásnak ellentétes lefutású DNS szál kapcsolódik össze hidrogénkötésekkel, melyek a molekula belsejében található szerves bázisok között alakulnak ki. Az egymással szemben álló bázisok kapcsolódását pontosan a hidrogénkötések kialakulásának lehetősége szabja meg, az adenin csak a timinnel tud párban állni, míg a guanin a citozinnal. Ez a szerkezet igazolta Chargaff 1949-es eredményeit is, melyek szerint a DNS-ben a négyféle nukleotid nem egyforma arányban fordul elő [2]. Később, az in vitro előállított és kikristályosított DNS molekulák röntgendiffrakciója és egyéb fizikai mérése bebizonyította a modell helyességét, de rávilágított arra is, hogy ez csak egy a több lehetséges térszerkezet közül. A régi modellnek megfelelő DNS szerkezetet B-DNS-nek nevezték el, azóta kimutattak A- és Z-DNS-t is. Ezek szintén kettős hélix szerkezetűek, pár paraméterükben különböznek csak a hatvanéves modelltől.
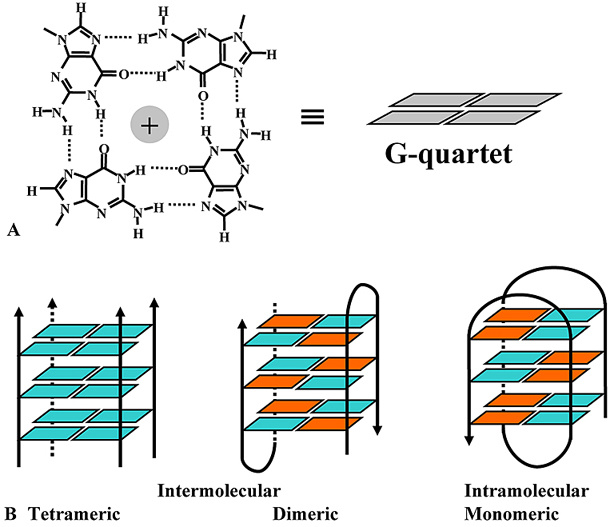
1962-ben, kilenc évvel a kettős hélix felfedezése után közölte le Gellert kollégáival a csak guaninból álló DNS-lánc általuk megfigyelt szerkezetét: a mesterségesen előállított DNS lánc röntgendiffrakciós képe négyes hélixet mutatott [3]. Később számos kísérlet igazolta a négyes hélix létét in vitro előállított DNS-szekvenciák esetén. Erre a speciális szerkezetre G-quadruplexként, G-tetrádként vagy G4-DNS-ként is hivatkoznak, pedig bármilyen nukleinsavban kialakulhat ez a szerkezet, nem DNS-specifikus. Négy guanin egy speciális, ún Hoogsteen hidrogénkötés kialakításával egy lapos struktúrát hoz létre, és ezek a guanintetrádokból álló síkok egymás fölé rendeződnek, így alakítva ki a G-quadruplex négyes hélixű szerkezetét. A tetrádokat kationok (általában kálium) stabilizálják. Attól függően, hogy hány molekula alkotja a négyes hélixet, három típus különböztethető meg, az intra-, a bi- illetve a tetramolekuláris, ezen kívül lehetnek parallel vagy antiparallel lefutásúak.
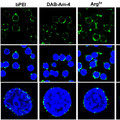
Élő sejtekben legelőször telomér régiókban mutatták ki a G-quadruplex struktúrákat. Az emberi telomér GGTTAG ismétlődéseket tartalmaz, és az itt található intramolekuláris G-quadruplexet NMR és röntgenkrisztallográfiás módszerekkel behatóan tanulmányozták. Ez a szerkezet jelentős szerepet játszik a telomeráz enzim gátlásában és a genom stabilitásának megőrzésében. A telomér régiókon kívül az utóbbi pár évben számos más lókuszon sikerült kimutatni e négyes hélixet, többek között az ubiquitin ligáz RFP2, a protoonkogén c- myc, c-kit, bcl-2, VEGF, H-ras és N-ras gének promoterében. Számos elmélet született már e szerkezet génexpressziót szabályozó funkciójáról, egyesek aktiváló, mások gátló funkciót kötnek hozzá. A négy guaninból álló sík számos molekulát képes specifikusan megkötni. Egy szintetikusan előállított G4-liganddal a G-tetrádok stabilizálása (amely egyébként a DNS replikációját és azt azt követő sejtosztódást gátolta) révén mutatták ki első ízben, hogy egy emberi sejtvonalban milyen sok aktív G-tetrád fordul elő [4].
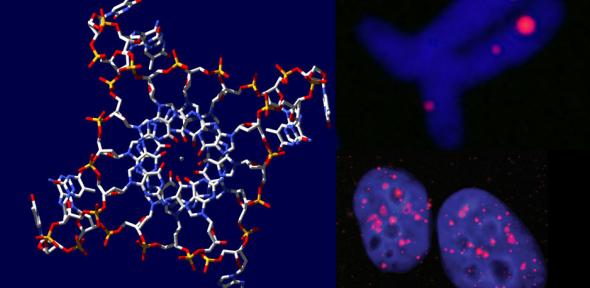
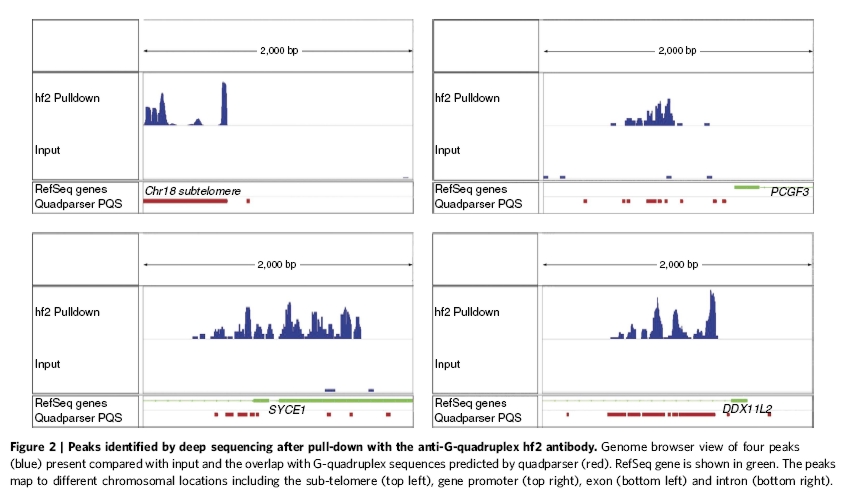
Számos algoritmust hoztak létre az utóbbi időben arra, hogy egy-egy genomot megvizsgálva megjósolják, potenciálisan hol alakulhat ki négyes hélix. Az egyik ilyen algoritmus több, mint 370000 ilyen helyet prognosztizált a humán genomban [5]. A Nature Communications április 30-i száma többek között arról számol be, hogy ezek közül a prediktált helyek közül melyek alkotnak valójában négyes hélixet. Mindezt humán immortalizált sejtvonalon (MCF7), a G-tetrádra specifikus ellenanyaggal végzett kísérleteikre alapozzák. Az hf2 ellenanyaggal végzett immunprecipitáció után a speciális szerkezettel szomszédos DNS darabokat megszekvenálták, hogy azonosítsák a G4-DNS-t tartalmazó lókuszokat. Számos guanintetrádot találtak a kromoszómák telomér régióiban és a heterokromatinban is. Ez utóbbiak közül jó néhány a gének előtt található reguláló szakaszban fordult elő.
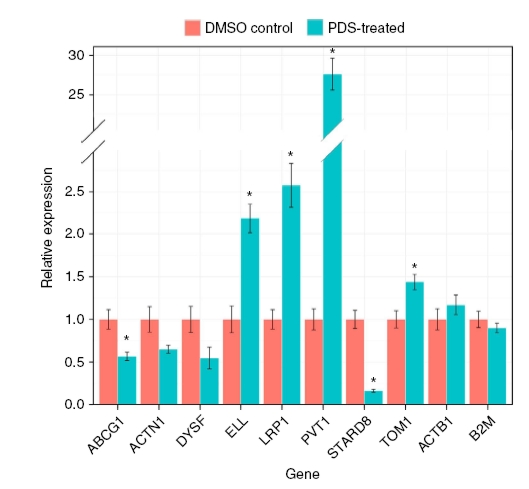
Hogy a négyes szerkezetnek a génexpresszióra gyakorolt hatását leellenőrizzék, tíz gén átíródását vizsgálták meg a pyridostatin (PDS) nevű G-tetrád stabilizáló liganddal kezelt illetve kezeletlen sejteken. A kísérletek alapján a négyes hélix stabilizálása bizonyos gének átíródását aktiválta, míg másokét gátolta. Az alábbi ábrán a csillaggal jelölt génexpressziós változások bizonyultak szignifikánsnak a két utolsó kontrollhoz képest.
 219 gén esetében a génen belül (5’-UTR, intron, 3’-UTR) találtak G-quadruplex szerkezetet. Mindezek alapján arra a következtetésre jutottak, hogy az adott szerkezet kialakulása a transzkripcióhoz köthető, így egy átíródó génben vagy az előtte levő reguláló szakaszon kialakuló négyes hélixet egy dinamikus folyamat egyik állomásának kell tekintenünk [6].
219 gén esetében a génen belül (5’-UTR, intron, 3’-UTR) találtak G-quadruplex szerkezetet. Mindezek alapján arra a következtetésre jutottak, hogy az adott szerkezet kialakulása a transzkripcióhoz köthető, így egy átíródó génben vagy az előtte levő reguláló szakaszon kialakuló négyes hélixet egy dinamikus folyamat egyik állomásának kell tekintenünk [6].
Ez az elmélet, mely szerint a génexpresszió (vagy a DNS-replikáció) egyik lépéseként négyes hélix alakul ki az addigi kettős spirálból, első hallásra furcsának tűnhet, ám Leméken kívül számos kutató oszt hasonló nézeteket. Zhang és kutatócsoportja alig egy hónapja publikálta a guaninban gazdag DNS-ek átíródásakor keletkező DNS-RNS alkotta hibrid G-quadruplexeiről szóló kutatását. Az n-ras promóter in vitro, azaz kémcsőben zajló transzkripciója esetén tapasztaltak hibrid négyes hélix képződést, mely a nem átíródó DNS szálból és a frissen szintetizálódó RNS molekulából képződött. Egy algoritmus segítségével rákerestek azokra a guaninban gazdag szekvenciákra, amelyek elvileg képesek lennének ilyen hibrid RNS-DNS négyes hélix kialakítására, és legnagyobb megdöbbenésükre az emberi gének 97%-ában találtak ilyen régiót, génenként átlag hetvenet. Több szövet transzkriptomát összevetve a kapott adatokkal azt az eredményt kapták, hogy az aktív génekben viszonylag kevés ilyen régió található meg, míg azok a gének, melyekben sok prediktált hibrid G4 szekvencia van, többnyire alig expresszálódnak [7]. Paeschke és munkatársai pedig a Nature május 9-i online kiadásában azt fejtegetik, hogy a DNS-replikáció kulcsfontosságú enzimei, a Pif1 helikázok a DNS megkettőződésekor keletkező négyszálú struktúrák kezelésére alakultak ki. Elméletük szerint a DNS szintézisekor a követő szálon kialakuló Okazaki fragmensek lehetőséget nyújtanak a különleges DNS-struktúrák, mint például a G-quadruplex kialakulásának, melyek megnövelik a kromoszómák törésének illetve átrendeződésének lehetőségét. Mindezek elkerülésére a sejtekben többféle mechanizmus is kialakult: az egyszálú DNS-t speciális fehérjék kötik meg, mint például a A replikációs fehérje RPA (replication protein A), mely azonban nem túl effektív olyan szakaszokon, ahol sok guaninismétlődés található. Az így kialakuló G4 szerkezeteket a Pif1 helikáz enzimcsalád tagjai tekerik ki hihetetlen gyorsan és effektíven. Paechke-ék élesztő kromoszómákba bevitt transzgéneket vizsgáltak normál és helikázmentes élesztősejtekben. Azt tapasztalták, hogy míg a normál sejtekben a transzgének inaktivációját legfeljebb a kromoszómák törése okozta, addig a Pif helikázt nem tartalmazó élesztőkben az inaktiválódó transzgének epigenetikai csendesítést (silencing) szenvedtek, vagyis a transzgén körüli kromoszómarészen a hisztonfehérjék olyan kovalens módosításon estek át, mely az ott található gének átíródását gátolta [8].
Mindezek alapján úgy tűnik, hogy a kétszálúnak megismert DNS molekula olyan, egyébként teljesen hétköznapi folyamatok során, mint pl a replikáció vagy a gének átíródása, képes a guaninban gazdag részeken egy speciális, akár csak DNS-ből, akár DNS-RNS hibridből álló négyes hélixű struktúra kialakítására. E struktúrák pontos funkciójáról még biztosan sokat fogunk még olvasni a közeljövőben, de egy biztos: a kettős és négyes hélix közti dinamikus átalakulás fontos tulajdonsága az örökítőanyagunknak.
1. ábra forrása: http://www.bbc.co.uk
2. ábra forrása: http://www.bioscience.org
1. Watson, J.D. and F.H. Crick, Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid.
Nature, 1953. 171(4356): p. 737-8.
2. Watson, B., Bell, Gann, Levine, Losick, Molecular Biology of the Gene. (Fifth Edition).
3. Gellert, M., M.N. Lipsett, and D.R. Davies, Helix formation by guanylic acid.
Proc Natl Acad Sci U S A, 1962. 48: p. 2013-8.
4. Biffi, G., et al., Quantitative visualization of DNA G-quadruplex structures in human cells.
Nat Chem, 2013. 5(3): p. 182-6.
5. Huppert, J.L. and S. Balasubramanian, Prevalence of quadruplexes in the human genome.
Nucleic Acids Res, 2005. 33(9): p. 2908-16.
6. Lam, E.Y., et al., G-quadruplex structures are stable and detectable in human genomic DNA.
Nat Commun, 2013. 4: p. 1796.
7. Zheng, et al., Co-transcriptional formation of DNA:RNA hybrid G-quadruplex and potential function as
constitutional cis element for transcription control Nucl. Acids Res, 2013.
8. Paeschke K, B.M., Garcia PD, Cejka P, Friedman KL, Kowalczykowski SC, Zakian VA.,
Pif1 family helicases suppress genome instability at G-quadruplex motifs. Nature, 2013.