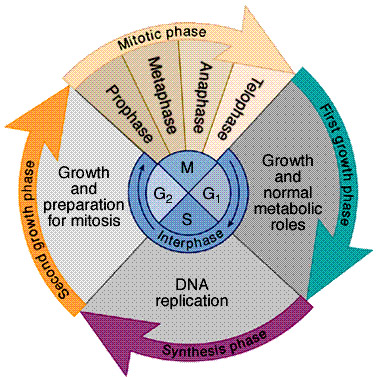
 Egy felnőtt ember normál testi sejtje csak meghatározott számú osztódásra képes. A kromoszómavégeken a DNS másolását végző enzimrendszer ugyanis nem képes hatékonyan működni (a jelenség hátteréről bővebben e régebbi posztban lehet olvasni), és mivel minden egyes sejtosztódás előtt a sejt DNS-állománya megkettőződik, a kromoszómák vége így minden egyes osztódás után egyre rövidebb lesz. Amikor az itt található telomér regió kb 50 osztódás után elér egy kritikus hosszt, az kivált egy specifikus reakciót (DDR - DNA damage response) a sejtekben. E folyamat eredményeként a sejt megáll a sejtciklus G1/S ellenőrzőpontján és nyugvó állapotba kerül, amiből semmilyen stimulus vagy növekedési faktor nem tudja kibillenteni. Ezt az állapotot hívják replikatív szeneszcenciának.
Egy felnőtt ember normál testi sejtje csak meghatározott számú osztódásra képes. A kromoszómavégeken a DNS másolását végző enzimrendszer ugyanis nem képes hatékonyan működni (a jelenség hátteréről bővebben e régebbi posztban lehet olvasni), és mivel minden egyes sejtosztódás előtt a sejt DNS-állománya megkettőződik, a kromoszómák vége így minden egyes osztódás után egyre rövidebb lesz. Amikor az itt található telomér regió kb 50 osztódás után elér egy kritikus hosszt, az kivált egy specifikus reakciót (DDR - DNA damage response) a sejtekben. E folyamat eredményeként a sejt megáll a sejtciklus G1/S ellenőrzőpontján és nyugvó állapotba kerül, amiből semmilyen stimulus vagy növekedési faktor nem tudja kibillenteni. Ezt az állapotot hívják replikatív szeneszcenciának.
A telomér régióban található DNS szekvencián (ami egyébként a TTAGGG nukleotidok tandem ismétlődése) DNS-kötő fehérjék ülnek, egy ún. shelterin komplexet hozva létre. Ez a komplex (és a kromoszóma legvégét alkotó guaninban gazdag egyszálú DNS-ből kialakuló szokatlan quadruplex szerkezet) védi meg a teloméreket attól, hogy azokat DNS-törésnek higgye a sejt hibajavító mechanizmusa, és két kromoszómavéget egymáshoz kapcsoljon. A telomérek tehát a kromoszómák integritásának és a genom stabilitásánk őrzői, nélkülük sokkal gyakoribbak lennének a kromoszóma-fúziók, a kromoszómavégek közti rekombináció és azoknak a DNS-hibajavító mechanizmus általi lebontása. De a legismertebb funkciójuk mégiscsak az osztódások számának limitálása [1].
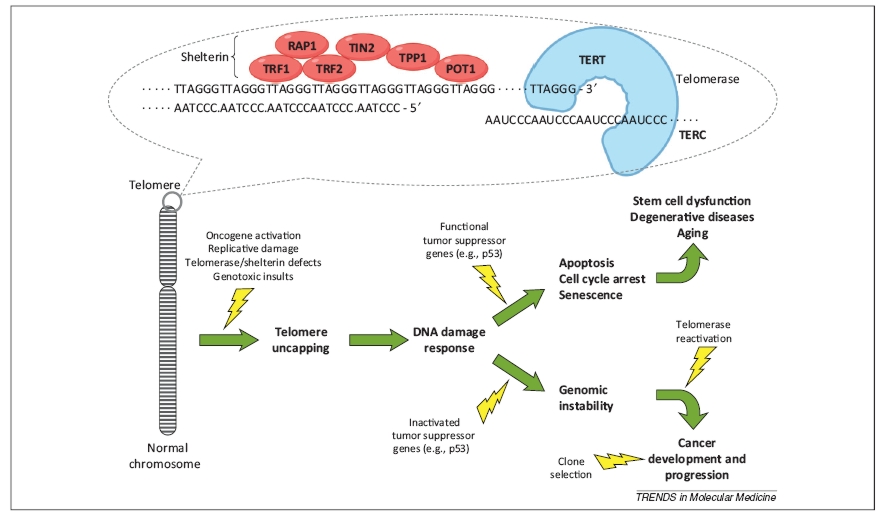
A normál tesi sejtekkel ellentétben az embrionális és szöveti őssejtek végtelenszer osztódhatnak, bennük ugyanis aktív a telomeráz nevű enzimrendszer, amelyik a telomér régiót alkotó ismétlődő szekvenciát újra meg újra létrehozza. A telomeráz komlpex két fő alkotóeleme a szintézis templátjául szolgáló, RNS-ből álló TERC (telomerase RNA component) és a katalitikus alegységet alkotó TERT (telomerase reverse transcriptase) fehérje. A telomeráz RNS komponense minden sejtben jelen van, míg a katalitikus alegység csak az őssejtekben termelődik.
Azok a sejtek, amelyekben a G1/S ellenőrző pont valami miatt hibásan működik (például olyan korai rosszindulatú rákos sejtek, melyekben a p53, p16 vagy CDKN2A fehérje expressziója lecsökkent vagy mutáció miatt a fehérjék egyike inaktív), képesek megszökni a replikatív szeneszcencia elől, és hiába érték el a kritikus telomér-hosszt, tovább osztódnak. A lerövidült kromoszómák ezekben a sejtekben később sokszor fuzionálnak, eltörnek, majd ismét összekapcsolódnak. Ezek a folyamatok az esetek többségében beindítják a programozott sejthalált (apoptózist), vagyis a rákos sejtek többsége elpusztul. Ám azok a sejtek, amelyekben valamilyen mechanizmussal a telomeráz enzim aktivizálódik, képessé válnak arra, hogy a kromoszómáikat stabilizálják. Ezek a sejtek immortalizálódnak, kvázi halhatatlanokká válnak – mindenféle megszorítás nélkül osztódhatnak ezután. Mint az immortalizált sejtvonalak vagy a rosszindulatú rákos sejtek. A rosszindulatú tumorok 90%-ára jellemző a telomeráz enzim aktív expressziója, és a fehérje mennyisége és a rákos betegség lefolyásának sebessége között pozitív korrelációt mutattak ki [1].
Nem csoda hát, hogy a tumorbiológia egyik fő kérdése az, hogy hogyan is szabályozódik a telomeráz reverz transzkriptáz (TERT) gén expressziója. Vajon milyen módon aktiválódik a normál szöveti sejtekben gátolt gén? Egyáltalán, hogyan működik ez a gátlás, és vajon a rákos sejtekben újra visszaállítható-e? Mivel a telomeráz ráktípustól függetlenül a rosszindulatú tumorok legtöbbjében jelen van, közkedvelt terápiás célpont. Mi sem lenne kívánatosabb, mint egy univerzális rákgyógyszer.
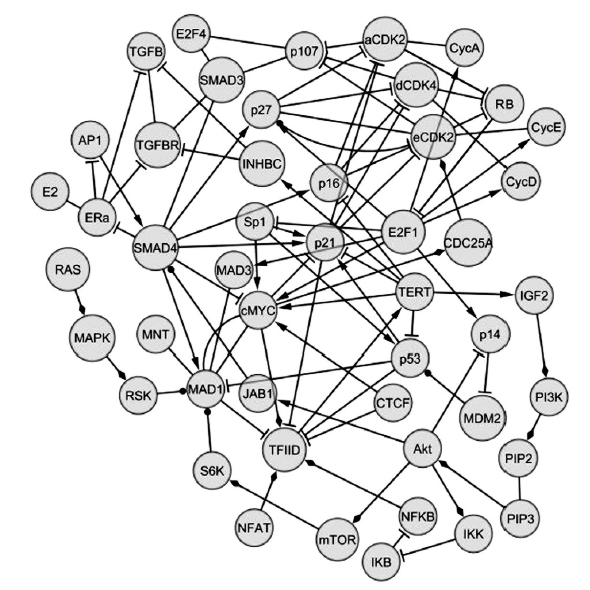
A humán TERT gén az 5-ös kromoszómán helyezkedik el, promótere nem tartalmaz TATA-box vagy CAAT elemeket, viszont CpG dinukleotidokban gazdag. A guaninban gazdag promóter hajlamos a telomérekben található speciális quadruplex struktúrák kialakítására – ezek olyan négyszálú DNS-hélixek, amelyekben guanintetrádok követik egymást. Ehhez a speciális quadruplex szerkezethez képes egy bizonyos fehérje kötődni, és befolyásolni a telomeráz átíródását. A még nem teljesen tisztázott quadruplexkötő fehérjén kívül számos más, hagyományos transzkripciós faktor is képes a promóterhez kötődni. A klasszikus represszor (vagyis a génexpressziót gátló) funkciót betöltő CTCF fehérje csak a TERT-et nem termelő sejtekben található meg a gén promóterén, így valószínű, hogy a normál szöveti sejtekben jelentős szerepe van az expresszió gátlásában, akárcsak az E-boxhoz kötődő Mad1-Max (igen, tudom, a vicces gén- illetve fehérjenevek megérnének egy külön posztot) komplexnek. A rákos sejtekben az utóbbi E-boxhoz a gátló komplex helyett a TERT gén átíródását aktiváló hírhedt onkogén, a c-Myc kötődik. Mielőtt azonban bárki elrettenne e aprólékos leírás láttán, megígérem, hogy nem megyek bele azon fehérjék értelmetlen felsorolásába, amelyekről az elmúlt 10 évben kimutatták, hogy szerepet játszanak a telomeráz katalitikus alegységének bekapcsolásában (az ilyen ínyencségek iránt érdeklődőknek álljon itt az alábbi hercig kis ábra az egymással is kapcsolatba lépő, a TERT promóteréhez kötődő TF-okról) [2].
A Science magazin legutóbbi számában két egymástól független kutatócsoport közölte le a TERT promóterének vizsgálatával kapcsolatos eredményeit. Mindkét csoport melanómás betegeket vizsgált, és a telomeráz reverz transzkriptáz promóterében talált génexpressziót befolyásoló mutációkat. Huang és munkatársai megszekvenált teljes humán rák genomokat hasonlítottak össze, és olyan mutációkat kerestek, melyek nem kódoló régiókat érintenek (vagyis nem a fehérjét kódoló szakaszon van a mutáció, hanem a szabályozásért felelős DNS-szakaszokon). Az általuk vizsgált malignus melanómák 70%-ában találtak összesen kétféle olyan pontmutációt, amelyek mindegyike a TERT promóterében található, és amely mutációk új transzkripciós faktor kötőhelyet hoztak létre. A mutáns és az eredeti promótereket luciferáz gén elé klónozva, különböző sejtvonalakban letesztelve két- illetve négyszeres expresszió-növekedést tapasztaltak. Vagyis a mutációk új TF-kötőhelyek kialakításával kétszer illetve négyszer annyi fehérje termelődését tették lehetővé [3].
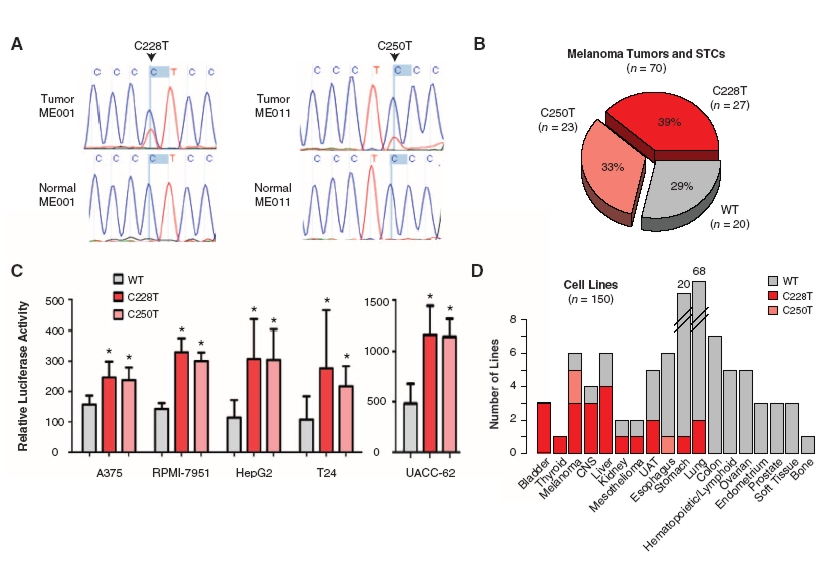
Horn és csapata egy teljesen más megközelítésből jutott hasonló eredményre. Ők egy olyan családot vizsgáltak, ahol négy generációban fordult elő tucatnyi melanómás megbetegedés, és egyik betegben sem találtak mutációt az eddig ismert melanómát okozó génekben, a CDK4-ben és a CDKN2A-ban. A kapcsoltsági analízis az 5-ös kromoszóma rövid szárára szűkítette le a keresést, majd célirányos high-throughput szekvenálással sikerült azonosítaniuk ebben a régióban hét mutációt. Ezek közül az egyik a TERT gén promóterében található pontmutáció, mely egy új transzkripciós faktor kötőhelyet hozott létre. A mutáció egy sporadikus (vagyis nem öröklődő) melanómában található hasonló mutációval sem egyezett, erre a családra volt csak jellemző. A mutáns promóter a luciferáz esszében másfélszeres aktivitást mutatott a kontrollhoz képest [4].
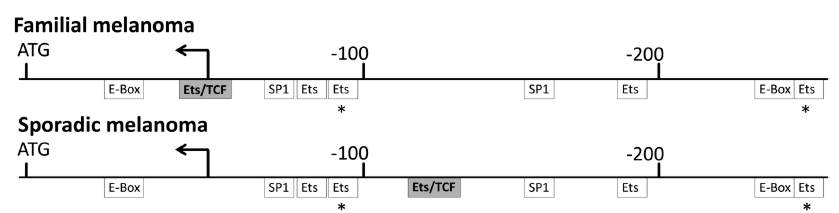
E két tanulmány új perspektívába helyezi a telomeráz reaktiválás kutatását és általában a rákkutatást, fókuszba hozva a cisz-reguláló elemek szerepét. Azok a sejtek, amelyek elkerülték a replikatív szeneszcenciát, és immár kontroll nélkül osztódnak, osztódásaik során sok mutációt képesek felhalmozni. Ezen mutációk némelyike érintheti kulcsfontosságú gének szabályozó régióit, új transzkripciós faktor kötőhelyeket hozva létre. Ezek a kötőhelyek aztán új szabályozási szintet iktathatnak be az adott gén expressziójába. Jelen esetben egy olyan gén promóterében jött létre több, egymástól független esetben mutáció, amely a rosszindulatú daganatok jelentős hányadában aktív, míg normál sejtekben inaktív. Egy új TF-kötőhely megjelenése felboríthatja azt az egyensúlyt, amit a promóterhez kapcsolódó fehérjék tartanak fenn, és a rákos transzformáción elindult sejtek ezáltal potenciálisan elkezdhetik termelni az addig represszált telomerázt. Az öröklődő mutáció megnöveli az azt hordozók esélyét arra, hogy melanóma alakuljon ki bennük, vagyis a telomeráz expressziójának gátlása labilissá vált a szöveti sejtjeikben. Így sajnos bennük a rákos sejtek kialakulásának kevesebb gátja van, mint azokban, akik nem hordozzák az adott mutációt.
Az első ábra forrása: schoolworkhelper.net
1. Mocellin, S., K.A. Pooley, and D. Nitti, Telomerase and the search for the end of cancer.
Trends Mol Med. 19(2): p. 125-33.
2. Daniel, M., G.W. Peek, and T.O. Tollefsbol, Regulation of the human catalytic subunit of telomerase (hTERT).
Gene. 498(2): p. 135-46.
3. Huang, F.W., et al., Highly recurrent TERT promoter mutations in human melanoma. Science. 339(6122):
p. 957-9.
4. Horn, S., et al., TERT promoter mutations in familial and sporadic melanoma. Science. 339(6122): p. 959-61.