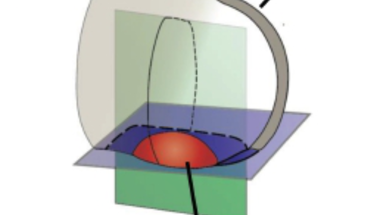
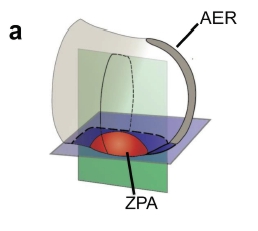
 A gerincesek végtagfejlődésének egyik sokat kutatott lépése az ujjak kialakulása. A folyamatban fontos szerepet játszó sonic hedgehog (Shh) molekula a fejlődő végtagkezdemény egyik speciális, polarizációs zóna (ZPA- zone of polarizing activity) nevű régiójában expresszálódik. A ZPA mezenhimális sejtek kis csoportja a végtagbimbó poszterior részén, mely meghatározza a később keletkező ujjak számát és milyenségét. Hatását hosszú távon fejti ki, vagyis az apikális ektodermális redő (AER) sejtjei, melyek reagálnak a Shh-szignálra, nem közvetlenül a ZPA sejtek mellett helyezkednek el.
A gerincesek végtagfejlődésének egyik sokat kutatott lépése az ujjak kialakulása. A folyamatban fontos szerepet játszó sonic hedgehog (Shh) molekula a fejlődő végtagkezdemény egyik speciális, polarizációs zóna (ZPA- zone of polarizing activity) nevű régiójában expresszálódik. A ZPA mezenhimális sejtek kis csoportja a végtagbimbó poszterior részén, mely meghatározza a később keletkező ujjak számát és milyenségét. Hatását hosszú távon fejti ki, vagyis az apikális ektodermális redő (AER) sejtjei, melyek reagálnak a Shh-szignálra, nem közvetlenül a ZPA sejtek mellett helyezkednek el.
A ZPA-val és a Shh-gal kapcsolatban a hosszú táv más szempontból is fontos keresőszó. Ugyanis a ZRS enhanszer, az a reguláló elem, ami meghatározza, hogy a Shh a ZPA sejtjeiben termelődjön, magától a shh géntől több, mint 1Mb (1 millió bázispárnyi) távolságra van, méghozzá egy másik gén (lmbr1) intronjában [1]. Ráadásul a shh gén és a ZRS enhanszer között több funkcionális és az egyedfejlődés adott szakaszában nem aktív gén található. Érdekes módon a gének sorrendje és az enhanszer elhelyezkedése szinténiát mutat az ember, az egér és a fugu (Fugu rubripes) genomjában is. Sőt, mi több, az egérben azonosított cisz-reguláló elemmel homológ hal enhanszer transzgén egér embriókban képes volt rekapitulálni az eredeti shh expressziót a fejlődő végtagban [1]. Hogy pontosan hogyan fejti ki specifikus hatását az enhanszer ekkora távolságon, arra van pár elmélet és persze pár kísérletes válasz, ám a hosszú távú cisz-reguláció mechanizmusa pontosan még mindig nem tisztázott.
Visszatérve a jelátvitelre, a végtagfejlődésben is szerepet játszó szignaling molekulák egy része egy adott sejtcsoportban termelődik, hatásukat viszont ezektől viszonylag távol található sejtekben fejtik ki. A jelátvivők terjedésének mechanizmusára számos elmélet létezik, gerinceseknél főként a passzív diffúzió és a transzcitózisnak nevezett aktív transzport az elfogadott – ez utóbbi esetben a molekulákat az arra nem válaszoló szomszédos sejtek felveszik, majd továbbadják. Gerinctelen embriók esetében leírtak olyan mechanizmust, melyben speciális sejtnyúlványok (citonémák) szállítják az adott jelátvivőt a felhasználó sejtekig. A Nature online kiadványában vasárnap megjelent publikáció szerint a gerinces embriókban a Shh is hasonló sejtnyúlványokon keresztül jut el a célsejtekig [2].
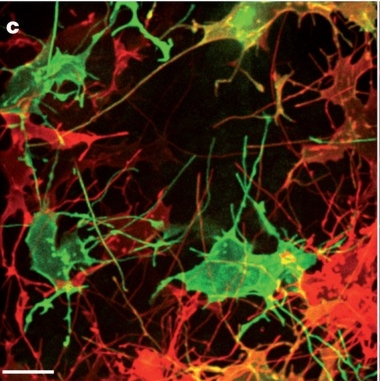 Sanders és kollégái transzgén csirkeembriók végtagbimbóit vizsgálták egy újfajta mikroszkópos technika segítségével, mely lehetővé tette számukra, hogy az élő embriókról sejtszintű, sőt sejtalkotószintű felbontásban time lapse felvételeket tudjanak készíteni. Az embriók olyan fluoreszcens transzgén konstrukciót tartalmaztak, mely a fejlődő végtagbimbó mezenhimális sejtjeinek membránját jelölte meg. A mikroszkópos képek egy, a mezenhimális sejtek vékony nyúlványaiból álló, összefüggő hálózatot mutattak. Egy mezenhimális sejt durván 35um kiterjedésű, az átlagosan 150um hosszú nyúlványok akár négy-öt sejtrétegen is túlnyúlnak. Átmérőjük azonban csak 200nm, így nem csoda, hogy konvencionális mikroszkópos módszerekkel mindez eddig láthatatlan volt. A nyúlványok csak membránkötött fluoreszcens fehérjékkel jelölhetőek, citoplazmában elhelyezkedő fluorofórok nem rajzolták ki a fenti mintázatot.
Sanders és kollégái transzgén csirkeembriók végtagbimbóit vizsgálták egy újfajta mikroszkópos technika segítségével, mely lehetővé tette számukra, hogy az élő embriókról sejtszintű, sőt sejtalkotószintű felbontásban time lapse felvételeket tudjanak készíteni. Az embriók olyan fluoreszcens transzgén konstrukciót tartalmaztak, mely a fejlődő végtagbimbó mezenhimális sejtjeinek membránját jelölte meg. A mikroszkópos képek egy, a mezenhimális sejtek vékony nyúlványaiból álló, összefüggő hálózatot mutattak. Egy mezenhimális sejt durván 35um kiterjedésű, az átlagosan 150um hosszú nyúlványok akár négy-öt sejtrétegen is túlnyúlnak. Átmérőjük azonban csak 200nm, így nem csoda, hogy konvencionális mikroszkópos módszerekkel mindez eddig láthatatlan volt. A nyúlványok csak membránkötött fluoreszcens fehérjékkel jelölhetőek, citoplazmában elhelyezkedő fluorofórok nem rajzolták ki a fenti mintázatot.
Ahogy a lenti videón is látszik, ezek a kitüremkedések folyamatosan nőnek illetve visszahúzódnak, míg egy másik sejt nyúlványával kapcsolatba nem lépnek.
További vizsgálatok kimutatták, hogy a nyúlványok aktin-alapú filopódiumok, vagyis állábak, melyekben a miozin-X-GFP motorfehérje a nyúlványok disztális fele felé vándorol. A funkcionális vizsgálatok alapján kiderült, hogy a végtagkezdemény filopódiaképző sejtjei között vannak a Shh-termelő ZPA-sejtek is, melyek nyúlványai elérik az apikális ektodermális redő (AER) Shh- illetve FGF-jelre válaszoló sejtjeit, és az AER sejtjei is, melyek nyúlványai a ZPA-sejtek felé irányulnak. A lenti videón éppen az látszik, ahogy a ZPA sejtjeiben a Shh molekulák kb 200nm átmérőjű csomagokban utaznak az állábak vége felé az aktin motorfehérjék segítségével.
Az AER sejtjeiben a Shh-receptorok illetve koreceptorok (PTC1, SMO, CDO, BOC) az állábak meghatározott régióba rendeződtek, és ezek a nyúlványok kapcsolatban álltak a Shh-termelő mezenhimális sejtek állábaival.
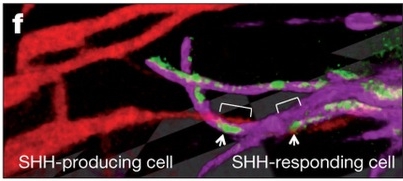
Az újfajta mikroszkópos technika felfedett előttünk tehát egy olyan, eddig a szemünk elől rejtett, sejtnyúlványokból álló hálózatot, mely közvetlen kapcsolatot biztosít egy, a jelátvitelben fontos molekulát termelő, és az arra válaszoló, egymástól azonban távol álló sejtek között. Hogy ez a fajta hálózat más, az egyedfejlődésben fontos szerepet játszó szignálok esetén is jelen van, továbbra is kérdéses, ám nem valószínű, hogy egyedi megoldás lenne a Shh-jelátvitelre.
1. Lettice, L.A., et al., A long-range Shh enhancer regulates expression in the developing limb and fin and is associated with preaxial polydactyly. Hum Mol Genet, 2003. 12(14): p. 1725-35.
2. Timothy A. Sanders, E. Llagostera, and M. Barna, Specialized filopodia direct long-range transport of SHH during vertebrate tissue patterning. Nature, 2013.