Ki ne hallott volna már az őssejtekről? Etikai kérdések központi témái, a média időről időre kerít valami izgalmas őssejtes hírt, az internet teli a köldökzsinórvérbankok és a gyógyíthatatlannak tartott betegségeket őssejtterápiával kezelő magánklinikák hirdetéseivel. Hovatovább, manapság már az öregedés elleni harc tuti befutói is lettek, mióta kiderült, hogy az embrionális őssejtekkel kezelt idős egerek háromszor hosszabb ideig élnek, mint a kezeletlen társaik [1]. De a legbizarrabb, szöveti sejteket őssejtekké újraprogramozó és azokat a maga önös érdekeire felhasználó élőlény mégsem az ember, hanem a leprát okozó Mycobacterium leprae.
 A jellegzetes végtagveszteséggel és az arc torzulásával járó betegség már az ókori Egyiptomban is szedte áldozatait, Európába első ízben Nagy Sándor “telepítette be” indiai hadjáratából visszatérve. Az ókorban és a középkorban örökletes betegségnek, átoknak vagy éppen büntetésnek vélték, a leprajárványok kezelése ennek megfelelően a különösen hatékony elkülönítés és megbélyegzés volt [2]. Aki azonban azt gondolná, hogy a lepra a letűnt idők betegsége, igencsak téved. A betegséget okozó, a tuberkulózis kórokozójával rokon baktériumokat 1873-ban fedezte fel Hansen, ám kezelésképpen még vagy hatvan évig legfeljebb a bőrolajfa (Hydnocarpus kurzii) olaját fecskendezték több-kevesebb sikerrel a leprás betegek bőre alá. 1950 óta alkalmazzák a dapszon nevű antibiotikumot a lepra terjedésének megállítására (nem sokkal később jelentek meg a dapszon-rezisztens Mycobacteriumok [3]), és 1990 óta 14 millió leprás beteget kezeltek világszerte. A betegség ellen folytatott ádáz küzdelemnek és a többféle antibiotikumból (dapszon, rifampicin és clofazimin) álló terápiának köszönhetően 2011-ben már “csak” közel 200 ezer új leprás fertőzést regisztrált a WHO [2].
A jellegzetes végtagveszteséggel és az arc torzulásával járó betegség már az ókori Egyiptomban is szedte áldozatait, Európába első ízben Nagy Sándor “telepítette be” indiai hadjáratából visszatérve. Az ókorban és a középkorban örökletes betegségnek, átoknak vagy éppen büntetésnek vélték, a leprajárványok kezelése ennek megfelelően a különösen hatékony elkülönítés és megbélyegzés volt [2]. Aki azonban azt gondolná, hogy a lepra a letűnt idők betegsége, igencsak téved. A betegséget okozó, a tuberkulózis kórokozójával rokon baktériumokat 1873-ban fedezte fel Hansen, ám kezelésképpen még vagy hatvan évig legfeljebb a bőrolajfa (Hydnocarpus kurzii) olaját fecskendezték több-kevesebb sikerrel a leprás betegek bőre alá. 1950 óta alkalmazzák a dapszon nevű antibiotikumot a lepra terjedésének megállítására (nem sokkal később jelentek meg a dapszon-rezisztens Mycobacteriumok [3]), és 1990 óta 14 millió leprás beteget kezeltek világszerte. A betegség ellen folytatott ádáz küzdelemnek és a többféle antibiotikumból (dapszon, rifampicin és clofazimin) álló terápiának köszönhetően 2011-ben már “csak” közel 200 ezer új leprás fertőzést regisztrált a WHO [2].
A pálcika alakú, valószínűleg cseppfertőzéssel terjedő és a sejteken belül élősködő baktérium rekord lassan osztódik, a sejtciklusa 13 nap, míg az E. coli körülbelül 20 percenként osztódik egyet. Laboratóriumi körülmények között leggyakrabban egér vagy tatu talppárnájában tenyésztik a sejteket - az emberen kívül ugyanis a kilencöves tatu a M. leprae egyik gazdaállata [4]. A betegség lepromatózus típusában a baktériumok a bőrön, a nyálkahártyákon és a belső szerveken a gümőkórhoz hasonló csomókat hoznak létre. A tuberkuloid típusú leprás megbetegedés során a fertőzés átterjed a perifériás érző- és mozgatóidegekre. A kezdeti érzéskiesést zsibbadás és mozgási nehézségek váltják fel, majd az ujjak, kezek, lábak elvesztése következik. Az orrcsontot és a szemet is megtámadó baktériumok az orr leesését illetve vakságot is okozhatnak [5]. Míg a baktérium a szervezetből a kombinált antibiotikum-terápiával kiirtható, az idegsejtkárosodás és a végtagveszteség sajnos nem gyógyítható.
A fertőzés korai lépéseit még mindig homály fedi, sokan valószínűsítik, hogy a baktériumok elsősorban a légzőszerveken keresztül jutnak be az emberi szervezetbe. Annyi bizonyos, hogy a tuberkuloid típusú lepra esetén a perifériás idegrendszert és a Schwann-sejteket egyszer csak eléri a fertőzés. A Schwann-sejtek egy vastag mielin-hüvelyt alkotnak a periféris idegsejtek axonjain, mely az axonon terjedő ingerület sebességét jelentősen befolyásolja. Ezek a dúcléc-eredetű (tehát ektodermális) sejtek igencsak plasztikusak, és a környéki idegrendszer regenerálódásában is kulcsszerepet játszanak. (A Schwann-sejtek működéséről itt található egy hasznos kisfilm.)
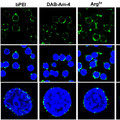
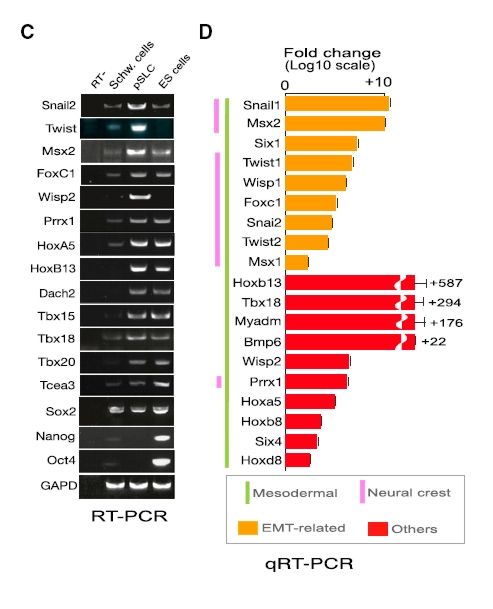 Már jó ideje ismert, hogy a Mycobacterium leprae ezeket a sejteket is megfertőzi, és bennük több évig szaporodik az immunrendszer elől védve [6]. Nemrég a Cell című folyóiratban számoltak be egérből izolált és M. leprae-vel fertőzött Schwann-sejtekkel kapcsolatos eredményekről [7]. Az RNS átiratok elemzése számos olyan gén emelkedett expresszióját mutatta ki, melyek embrionális állapotban aktívak, a transzkripcióban, a kromatin átrendeződésében, a jelátvitelben illetve a sejtosztódásban és a DNS replikációban vesznek részt. A fertőzött Schwann-sejtek sorsát 4 héten át követve azt a meghökkentő eredményt kapták, hogy a baktérium számos, az egyedfejlődés során fontos, főként homeodomén, homeobox, EMT, mezodermális illetve dúcléc-vonalra jellemző gén expresszóját kapcsolta be, míg a Schwann-sejtekre jellemző géneket kikapcsolta.
Már jó ideje ismert, hogy a Mycobacterium leprae ezeket a sejteket is megfertőzi, és bennük több évig szaporodik az immunrendszer elől védve [6]. Nemrég a Cell című folyóiratban számoltak be egérből izolált és M. leprae-vel fertőzött Schwann-sejtekkel kapcsolatos eredményekről [7]. Az RNS átiratok elemzése számos olyan gén emelkedett expresszióját mutatta ki, melyek embrionális állapotban aktívak, a transzkripcióban, a kromatin átrendeződésében, a jelátvitelben illetve a sejtosztódásban és a DNS replikációban vesznek részt. A fertőzött Schwann-sejtek sorsát 4 héten át követve azt a meghökkentő eredményt kapták, hogy a baktérium számos, az egyedfejlődés során fontos, főként homeodomén, homeobox, EMT, mezodermális illetve dúcléc-vonalra jellemző gén expresszóját kapcsolta be, míg a Schwann-sejtekre jellemző géneket kikapcsolta.
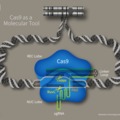
A Schwann-sejtekben ezek szerint nemcsak osztódik a lepra kórokozója, hanem azokat fokozott sejtosztódásra is kényszeríti, illetve át is programozza azokat progenitor/őssejt-szerű sejtekké (progenitor/stem-like cells - pSLC), melyek elvesztik eredeti funkciójukat, és ez a mielin-hüvely degradálódásához, majd a perifériás idegek elhalásához vezet.
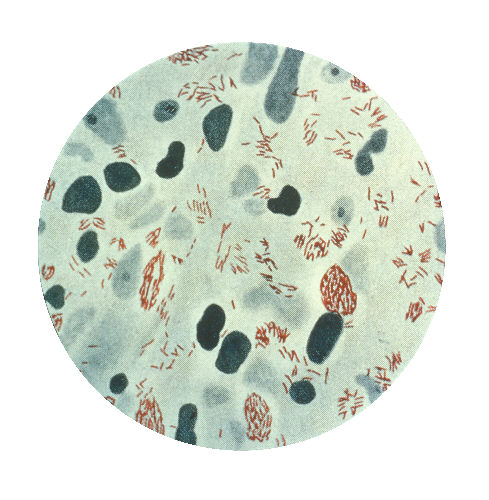
Ezek az átprogramozott Schwann-sejtek egerekbe beoltva képesek voltak váz- és simaizomszövetté differenciálódni (ezek viszont már többnyire mezodermális eredetű szövetek). A sejtek beépültek a vázizomzatba, a bőr alatti simaizom-rétegbe, illetve a vérerek falába (itt is találhatók simaizomsejtek), amely lehetővé tette a bennük élősködő mikróbák számára új sejtek és szövetek megfertőzését (a képeken a vázizomzatban található baktériumokat a nyíllal jelölt helyeken láthatjuk).
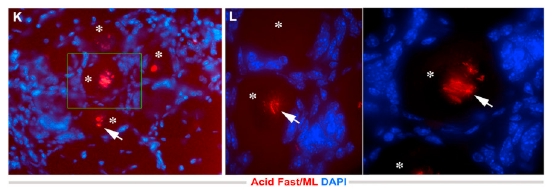
Nem rossz, mi? Eddig azt hitték, hogy a lepra által okozott izomsorvadás az ideg-degenerálódás következménye, most azonban kiderült, hogy a baktérium közvetlenül is pusztítja az izomsejteket. És még nem értünk a történet végére. A pSLC sejtek a redifferenciáción kívül képesek még az immunrendszer befolyásolására is különféle kemokinek, citokinek, növekedési faktorok és szolubilis adhéziós receptorok szekréciójával. Ezek a kibocsájtott molekulák makrofágokat vonzanak a fertőzött sejtekhez, majd a kialakult kötőszöveti granulómák baktériumokkal fertőzött makrofágokat engednek szabadjára. Ezek a sejtek aztán nagy szerepet játszanak a fertőzés egyéb szövetbe juttatásában.
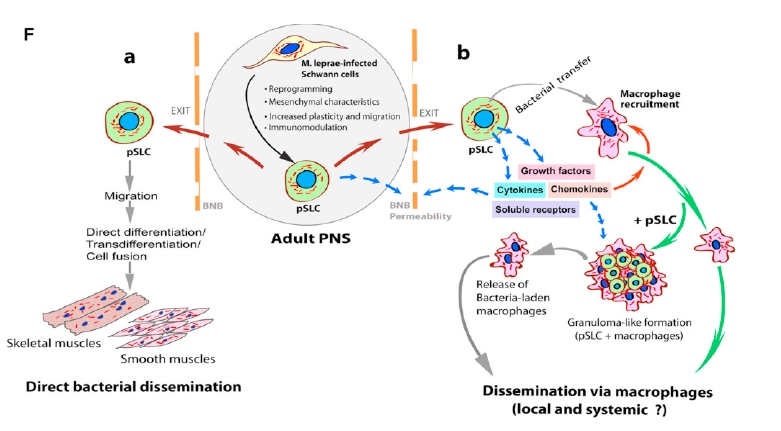
A lepra kórokozója tehát kihasználva a Schwann-sejtek plaszticitását átprogramozza azokat őssejtszerű sejtekké, melyek mezenchimális karakterrel bírnak. Ezek a speciális pSLC sejtek aztán elhagyják a perifériás idegrendszert és vagy izomsejtekké válnak, vagy pedig növekedési faktorokat és kemoattraktánsokat kibocsájtva makrofágokat vonzanak magukhoz, a makrofágokat megfertőzik, melyeknek aztán képesek a bakteriális fertőzést további szövetekbe eljuttatni. Ezek az eredmények teljesen új megvilágításba helyezik a M. leprae és a gazdaszervezete közötti kölcsönhatásokat és potenciálisan új terápiás lehetőségek előtt nyitnak utat.
Az első két ábra forrása: wikipedia.org és stanford.edu
1. Lavasani, M., et al., Muscle-derived stem/progenitor cell dysfunction limits healthspan and lifespan in a murine progeria model. Nature communications, 2013. 3: p. 608.
2. http://www.who.int/lep/en/.
3. Friedmann, P.S., Dapsone-resistant leprosy. Proc R Soc Med, 1973. 66(7): p. 623-4.
4. http://www.stanford.edu/group/parasites/ParaSites2005/Leprosy/bio.htm.
5. Proctor, J.W., Leprosy in Massachusetts-Its Diagnosis and Segregation. Am J Public Hygiene, 1907. 17(1): p. 78-94.
6. Palmer, E., R.J. Rees, and G. Weddell, Experimental studies on nerve fibers in leprosy. I. The reaction of rat Schwann cells toward carbon particles, Mycobacterium lepraemurium and Mycobacterium leprae. Int J Lepr, 1965. 33(2): p. 137-59.
7. Masaki, T., et al., Reprogramming adult schwann cells to stem cell-like cells by leprosy bacilli promotes dissemination of infection. Cell, 2013. 152(1-2): p. 51-67.