Az elevenszülést általában az emlősökre jellemző tulajdonságnak tartjuk, pedig a legkülönbözőbb élőlénycsoportokban alkult ki egymástól függetlenül. Ma egy kevésbé ismert példáról lesz szó, a cecelégyről. A "cecelégy" alatt nem egyetlen fajt értünk, a Glossina genus körülbelül két tucat fajt tartalmaz, jelentősége nem is ebben rejlik, hanem hogy ezek a jószágok terjesztik az álomkórt, és egy rakás hozzá hasonló állatbetegséget, amelyek igen komoly problémát jelentenek a Szaharától délre. Mivel ilyen fontos kórokozók köztes gazdája, így folyamatosan keresik a módját, hogyan lehetne kiirtani, ezért viszonylag alaposan vizsgálták, így viszonylag pontosan ismerjük a szaporodását is.
Az elevenszülést általában az emlősökre jellemző tulajdonságnak tartjuk, pedig a legkülönbözőbb élőlénycsoportokban alkult ki egymástól függetlenül. Ma egy kevésbé ismert példáról lesz szó, a cecelégyről. A "cecelégy" alatt nem egyetlen fajt értünk, a Glossina genus körülbelül két tucat fajt tartalmaz, jelentősége nem is ebben rejlik, hanem hogy ezek a jószágok terjesztik az álomkórt, és egy rakás hozzá hasonló állatbetegséget, amelyek igen komoly problémát jelentenek a Szaharától délre. Mivel ilyen fontos kórokozók köztes gazdája, így folyamatosan keresik a módját, hogyan lehetne kiirtani, ezért viszonylag alaposan vizsgálták, így viszonylag pontosan ismerjük a szaporodását is.
Annak idején az iskolában azt tanultuk, hogy a rovarok petéket raknak, amikből lárvák kelnek ki. A cecelégy is valahogyan így kezdi, azonban egyszerre csak egyetlen egy pete érik meg a testében, ami a nőstény testén belül marad, a méhben, ahol a kikelő lárva az egész lárvális életét tölti. Amikor befejezte a lárvális fejlődést, az anyaállat kitojja a lárvát, ami azonnal bebábozódik, majd a bábból később kikel a kifejlett légy. Ebben az életciklusban a legszokatlanabb az az egészen nyilvánvaló tény, hogy a lárvának nincs ideje táplálkozni, az összes tápanyagot, ami egy kifejlett légy kikeléséhez szükséges az anyaméhen belül kell magához vennie. No de hogyan csinálja ezt a légy? A méh egy izmos falú, tracheákkal gazdagon behálózott falú szerv, ami elég nagy ahhoz, hogy egy harmadik lárvastádiumban lévő lárva is elférjen benne, amelynek a tömege megegyezik az anyaállatéval, hiszen a méhen kívül már nem táplálkozik, odabent kell elérnie a kifejlett testtömegét. A méhen belüli fejlődés meglepően hosszú, (A második ábrán, a nőstény ivarszerve látható az egyes időpontokban.) ez alatt az anyaállat a lárvát egy tejmiriggyel táplálja, amely a zsírtest közé benyomuló csőszerű mirigyekből áll. A mirigyek üregét kiválasztósejtek veszik körül, amelyek a tápláló tejet állítják elő a terhesség alatt. A cecelégy három különböző endoszimbionta baktériumot is hordoz, a Wolbachia pipientis (1, 2, 3) a petefészekben él és a petékkel együtt adódik át nemzedékről nemzedékre. A Sodalis glossinidius és a Wigglesworthia glossinidia is feltételezhetően a tejmirigyek váladékával kerül át az utódba. A tejmirigyek váladéka főleg fehérjéket és lipideket tartalmaz, két tejfehérje ismert, a tejmirigy fehérje (milk gland protein - GmmMGP) és a traszferrin (GmmTRF), más fehérjéket is kimutattak már, de ezek gyakorlatilag ismeretlenek. A szaporodás szempontjából fontos még a pete szikanyagát adó szikfehérje (yolk protein 1 - GmmYP1).
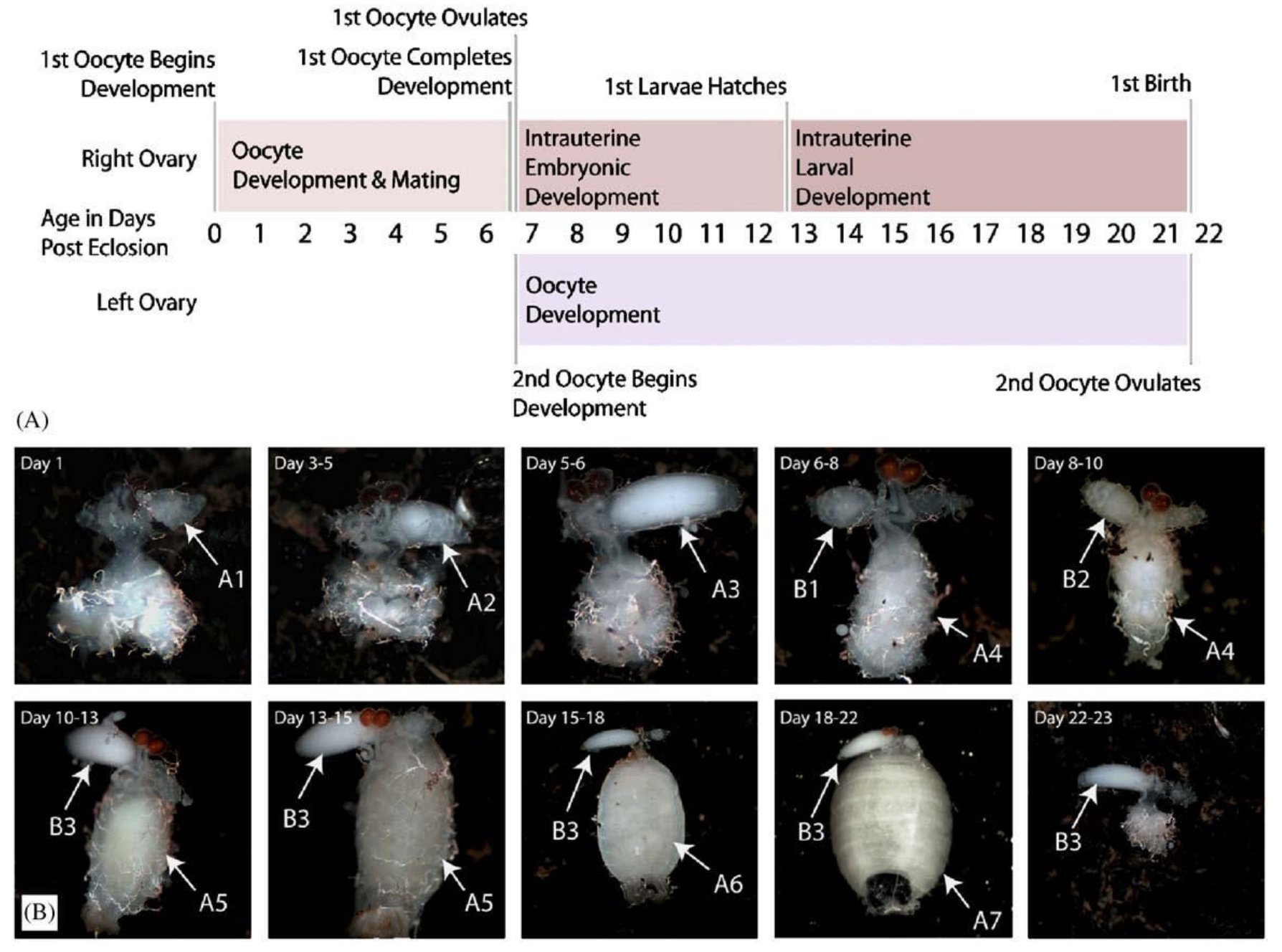
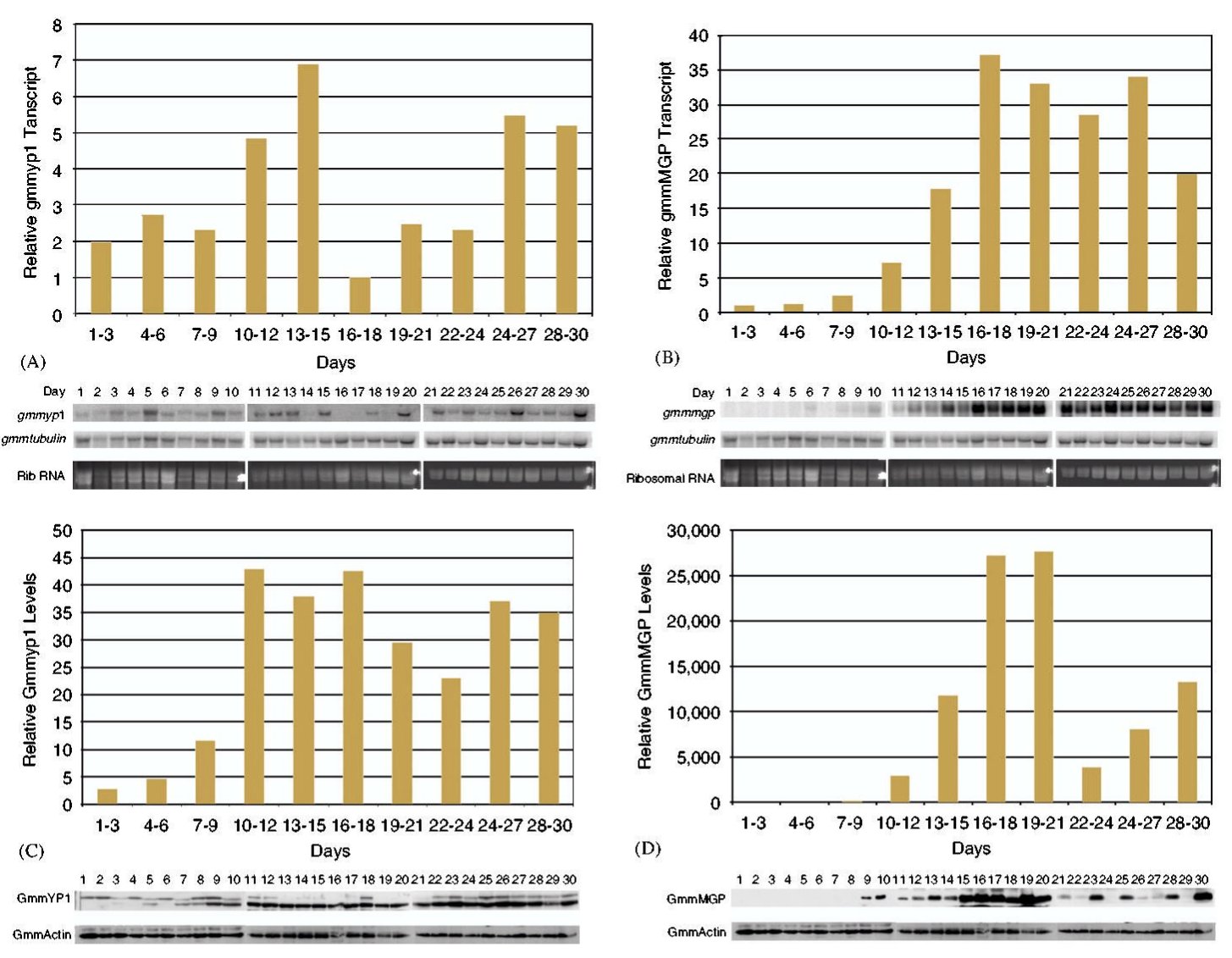
Mivel a szaporodásából következően a cecelégy nem túl szapora rovar, egy nőstény élete során 8-10 utódot képes csak kihordani, kézenfekvőnek tűnik, hogy az álomkór visszaszorításához vezető egyik fontos lépés lenne a cecelégy szaporodásának befolyásolása. Ez annál inkább lehetséges, mivel a nőstény cecelégy életében általában csak egyszer párzik, a spermiumokat eltárolja és azokkal termékenyíti meg a többi petét is. Geoffrey M. Attado és munkatársai azt vizsgálták, hogyan is működik a cecelégy szaporítószerve. Először northern blot módszerrel megvizsgálták, hogy a GmmMGP és a GmmYP1 gének kifejeződése hogy változik a szaporodási ciklus alatt, ez látható a harmadik ábrán (A és B), de érdekes módon western blot módszerrel azt is megvizsgálták, hogy mennyi fehérje transzlálódik a messenger RNSről (C és D). Nem meglepő módon a pete érése és az embrionális fejlődés során sok szikfehérje termelődik és kevés tejfehérje, míg a lárva kikelése után kevés szikfehérje és sok tejfehérje.
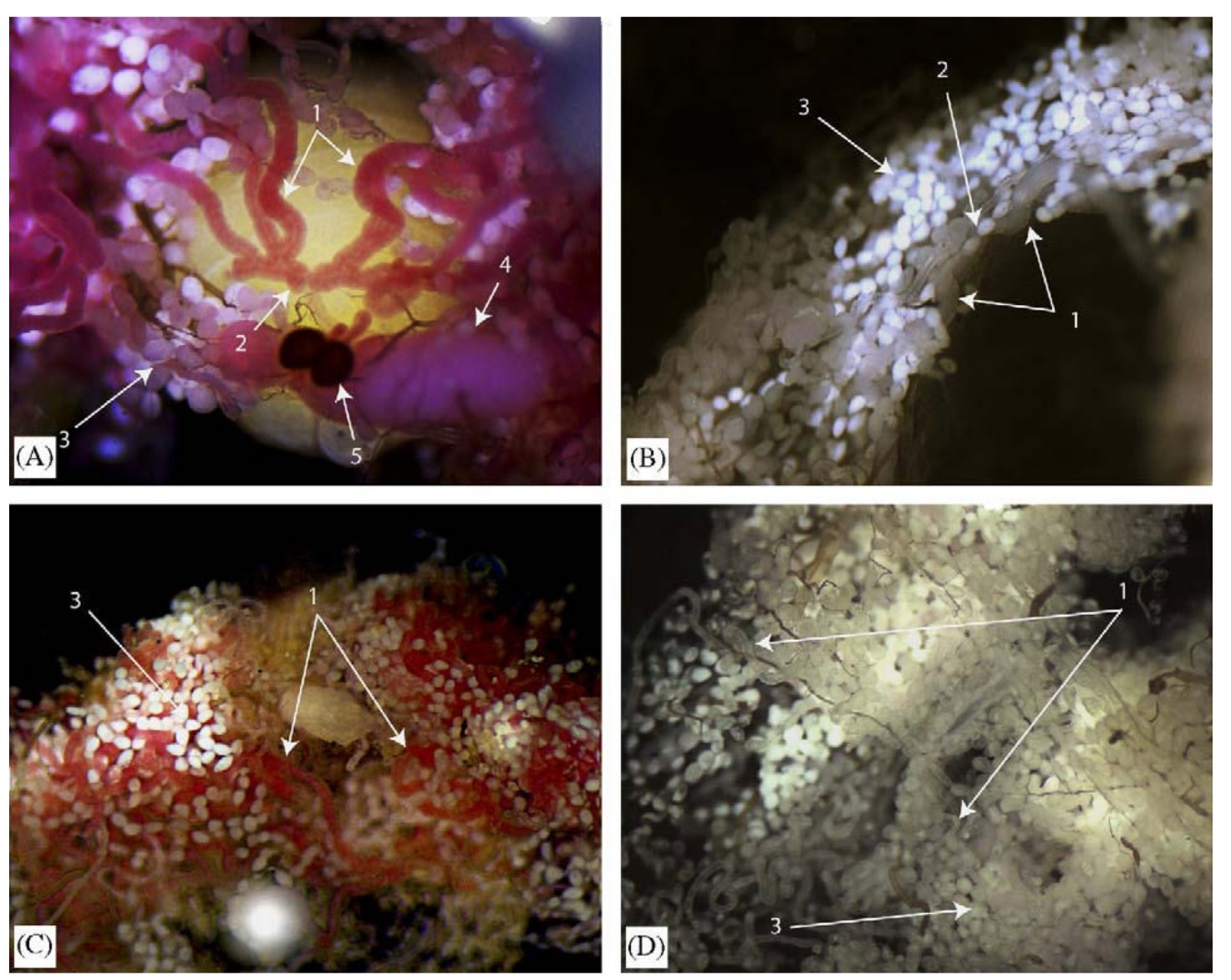
Nem meglepő módon azt tapasztalták, hogy az ivarszervekben fejeződik ki a szikfehérje, míg a tejmirigyekben a tejfehérje, ezt mutatja a következő ábra. itt az "1" nyíl mutat a tejmirigyekre, a "2" nyíl a méhre, a "3" nyíl a zsírtestre, a "4" nyíl a fejlődő petére, az "5" nyíl pedig a spermatékára. Az A és C ábra mutatja az immunhisztokémiás festést, a B és D kép a negatív kontroll, ahol immunizálatlan állat savóját használták elsődleges ellenanyagként.
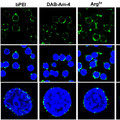
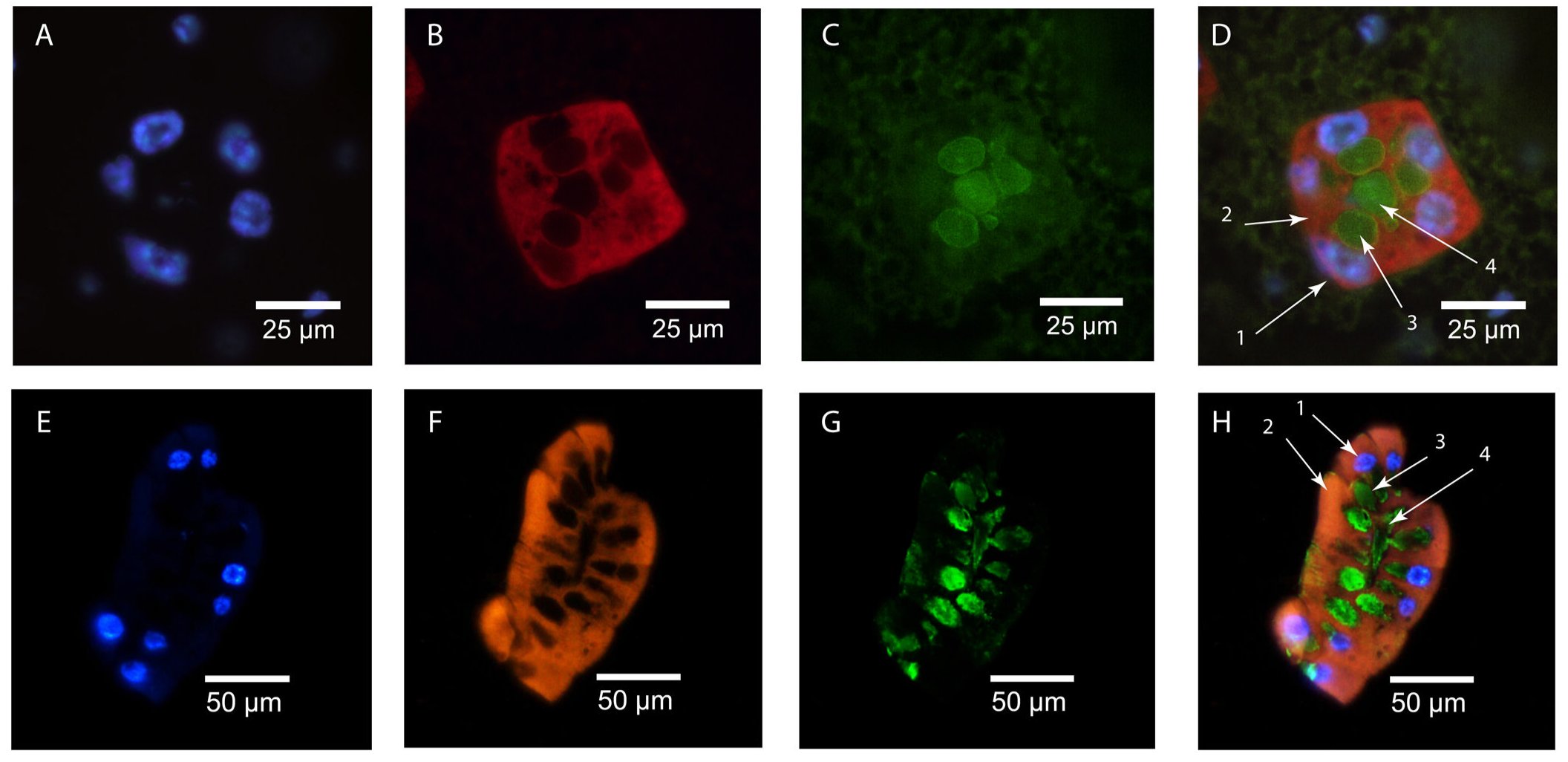
A következő cikkükben már kifinomultabb módszerekkel vágtak neki a vizsgálatoknak, pontosan meg tudták határozni, hogy fejeződik ki a gmmmgp gén és hol található a GmmMGP fehérje. Ezt mutatja a következő ábra. A fölső sor a keresztmetszeti kép, az alsó a hosszmetszeti. A kék egy DNS festék (DAPI), ami a sejtmagokat jelöli ki, a narancssárga a gmmmgp RNS -t jelöli ki in situ RNS hibridizálással, a zöld a GmmMGP fehérje immunfluoreszcens festésének az eredményét mutatja. Világosan látszik, hogy a tejfehérjét a tejmirigy üregét körülvevő kiválasztósejtek termelik, bennük fejeződik ki a gmmmgp gén, majd a fehérjét a tejmirigy üregébe továbbítják. Ugyanígy megvizsgálták a transzferrin fehérje kifejeződését is, hasonló festődést tapasztaltak, a transzferrint is a kiválasztósejtek termelik és a tejmirigy üregébe juttatják.
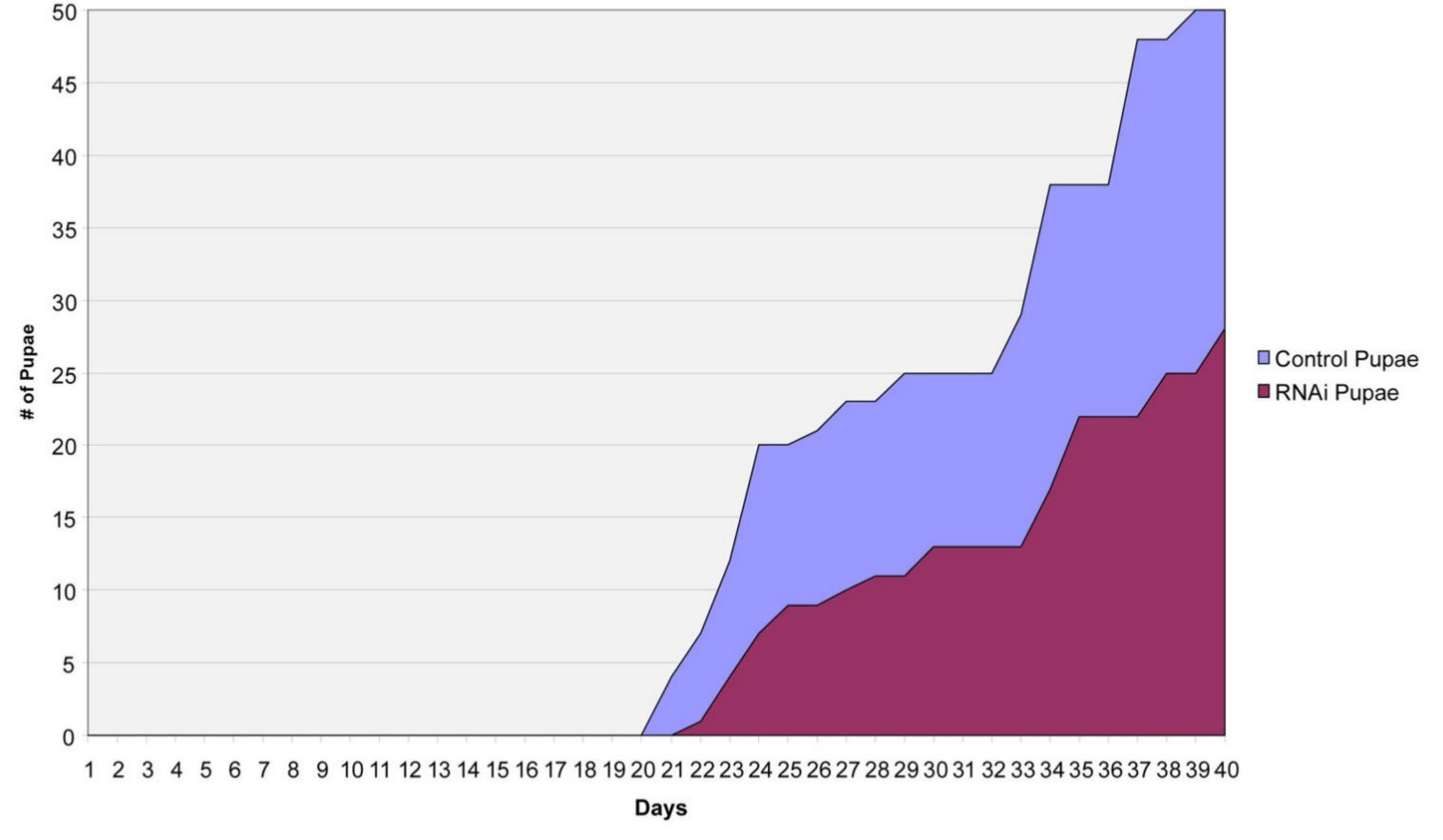
RNS inhibícióval lecsökkentették a gmmmgp RNS mennyiségét a nőstényekben, aminek hatására a vizsgált egyedek feleannyi utódot hoztak világra, mint a kontroll kettősszálú RNS -sel kezelt állatok (a két csoport által lerakott bábok számát mutatja a következő ábra), ebből arra következtettek, hogy a tejfehérje szükséges az utód kifejlődéséhez.
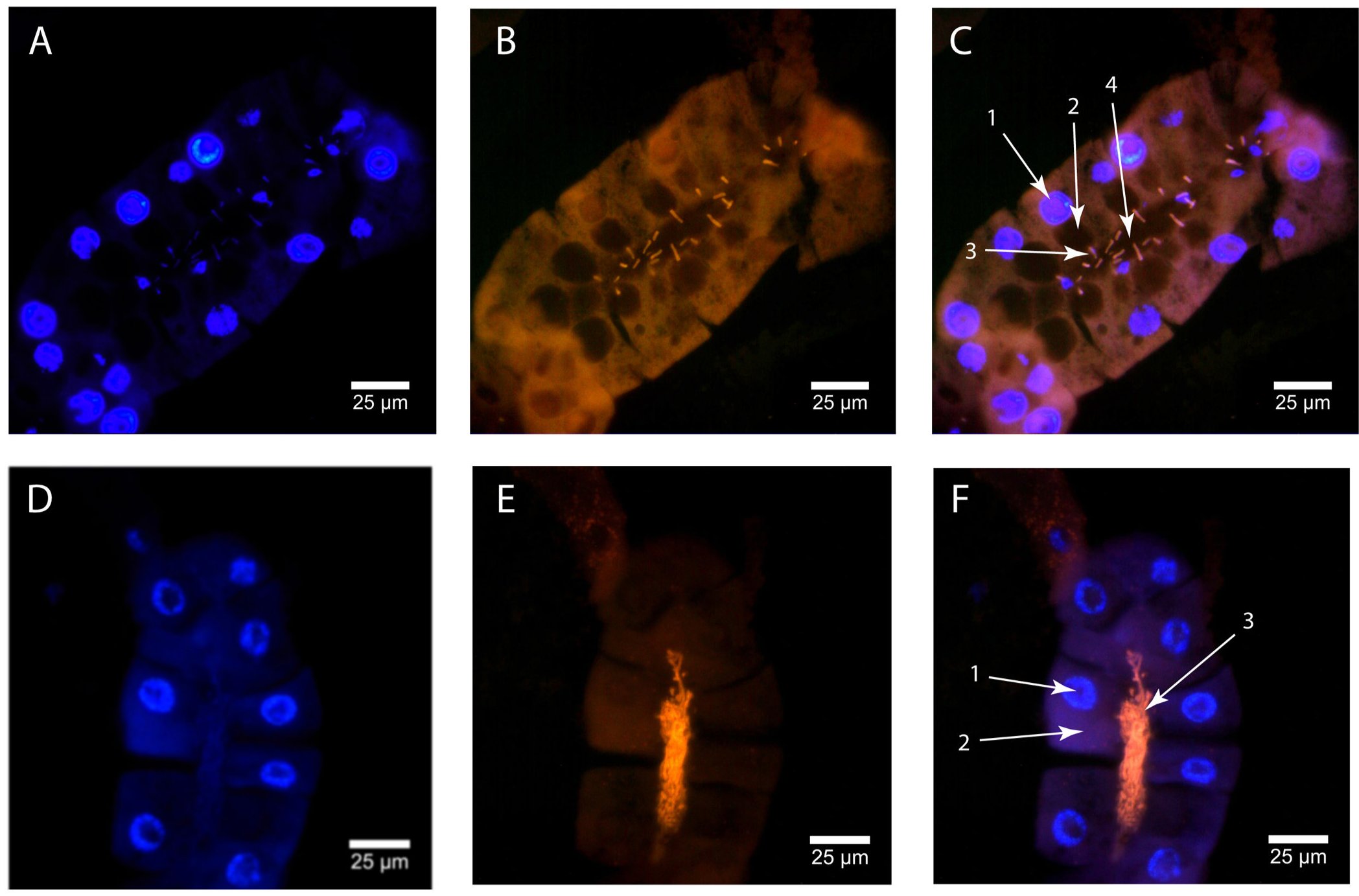
Megvizsgálták a szimbionta baktériumok eloszlását is a tejmirigyekben, ez látható a következő ábrán. Azt tapasztalták, hogy a Sodalis sejtek a tejmirigy üregében és a kiválasztósejtek citoplazmájában is kimutathatóak, míg a Wigglesworthiák kizárólag a tejmirigyek üregében láthatóak.
A Sodalis endoszimbionták eloszlása:
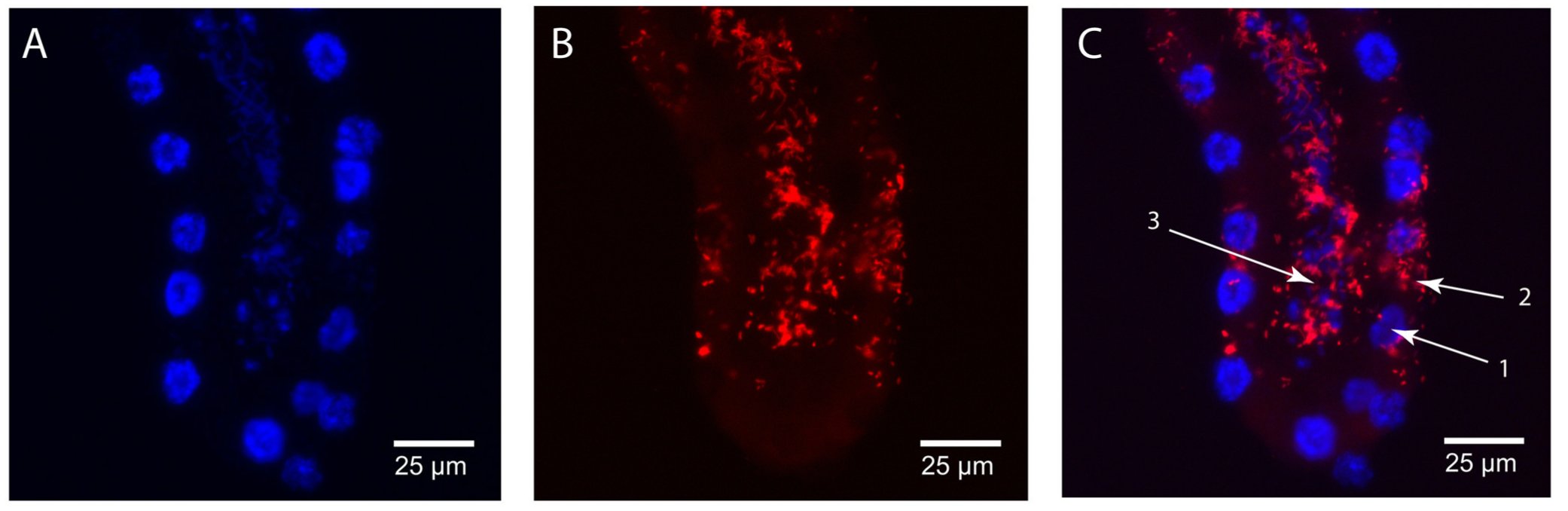
A Wiggleswothiák eloszlása:
A cecelégy szaporodása mindenképpen szokatlan az ízeltlábúak között, nyilván az teszi lehetővé ezt a roppant energiaigényes terhességet, hogy a légy nagy termetű emlősállatok vérével táplálkozik, így elég tápanyaghoz jut, hogy ellássa az utódait egész lárvális életükben. Egyelőre elég kevéssé ismerjük még ennek a szaporodási módnak a hátterét, de amint látható, vannak akik ezt a jószágot kutatják.
Attardo GM, Guz N, Strickler-Dinglasan P, Aksoy S. (2006): Molecular aspects of viviparous reproductive biology of the tsetse fly (Glossina morsitans morsitans): regulation of yolk and milk gland protein synthesis. J Insect Physiol. 2006 52(11-12):1128-36.
Attardo GM, Lohs C, Heddi A, Alam UH, Yildirim S, Aksoy S. (2008): Analysis of milk gland structure and function in Glossina morsitans: Milk protein production, symbiont populations and fecundity. J Insect Physiol. 54(8):1236-42