 Az altruizmus, vagyis a másokon való, személyes hasznot nem hajtó segítés, tipikusan olyan tulajdonságnak tűnhet, amihez minimum komplex idegrendszerre, vagy akár valamilyen morál-tudatra van szükség.
Az altruizmus, vagyis a másokon való, személyes hasznot nem hajtó segítés, tipikusan olyan tulajdonságnak tűnhet, amihez minimum komplex idegrendszerre, vagy akár valamilyen morál-tudatra van szükség.
A múlt héten megjelent Nature cikk alapján ez azonban erősen kétségesnek tűnik.
A szóban forgó kísérlet elsőre zseniálisan egyszerű: egy baktériumtenyészetet egyre növekvő antibiotikum koncentrációjú közegben kezdtek el nevelni és figyelték, hogy miként változik a teljes szuszpenzió rezisztenciája.
A felhasznált norfloxacint úgy adagolták egy bioreaktorba, hogy kb. 40%-át tegye lehetővé normális növekedési potenciálnak. Ezt az értéket (minimum inhibitory concentration - MIC) minden nap újra meghatároztak, és amikor a rezisztencia növekedni kezdett, emelték az antibiotikum koncentrációt is.
A klasszikus elmélet az mondaná, hogy a teljes bakteriális populáció rezisztenciájában való növekedést az okozza, hogy egy-egy egyedben kialakul a rezisztencia, majd ennek az egyednek az utódjai nagyon gyorsan elterjednek és a növekedési potenciál változása ennek a folyamatnak köszönhető. És ha egyből nagy antibiotikum koncentrációval ütnénk a bacikat valószínűleg ez is történne. Ellenben a fokozatosság mellett valami mást lehetett megfigyelni.
 Az altruizmus, vagyis a másokon való, személyes hasznot nem hajtó segítés, tipikusan olyan tulajdonságnak tűnhet, amihez minimum komplex idegrendszerre, vagy akár valamilyen morál-tudatra van szükség.
Az altruizmus, vagyis a másokon való, személyes hasznot nem hajtó segítés, tipikusan olyan tulajdonságnak tűnhet, amihez minimum komplex idegrendszerre, vagy akár valamilyen morál-tudatra van szükség.
A múlt héten megjelent Nature cikk alapján ez azonban erősen kétségesnek tűnik.
A szóban forgó kísérlet elsőre zseniálisan egyszerű: egy baktériumtenyészetet egyre növekvő antibiotikum koncentrációjú közegben kezdtek el nevelni és figyelték, hogy miként változik a teljes szuszpenzió rezisztenciája.
A felhasznált norfloxacint úgy adagolták egy bioreaktorba, hogy kb. 40%-át tegye lehetővé normális növekedési potenciálnak. Ezt az értéket (minimum inhibitory concentration - MIC) minden nap újra meghatároztak, és amikor a rezisztencia növekedni kezdett, emelték az antibiotikum koncentrációt is.
A klasszikus elmélet az mondaná, hogy a teljes bakteriális populáció rezisztenciájában való növekedést az okozza, hogy egy-egy egyedben kialakul a rezisztencia, majd ennek az egyednek az utódjai nagyon gyorsan elterjednek és a növekedési potenciál változása ennek a folyamatnak köszönhető. És ha egyből nagy antibiotikum koncentrációval ütnénk a bacikat valószínűleg ez is történne. Ellenben a fokozatosság mellett valami mást lehetett megfigyelni.
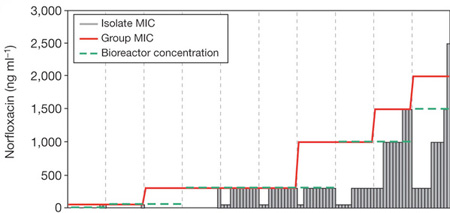 Ha tizenkét izolátumot vettek ki a teljes szuszpenzióból, akkor arra lehetett rácsodálkozni, hogy azok elsöprő többségének lényegesen alacsonyabb volt az antibiotikum toleranciája, mint a teljes tenyészeté, illetve időnként volt egy-egy izolátum, ami meg az átlagosnál magasabb toleranciát mutatott. Ez pedig azt sugallta, hogy a teljes közösség mindössze néhány egyede szedett össze rezisztenciát okozó mutációt, a többieknek valahogy ezek segítenek túlélni.
Ha tizenkét izolátumot vettek ki a teljes szuszpenzióból, akkor arra lehetett rácsodálkozni, hogy azok elsöprő többségének lényegesen alacsonyabb volt az antibiotikum toleranciája, mint a teljes tenyészeté, illetve időnként volt egy-egy izolátum, ami meg az átlagosnál magasabb toleranciát mutatott. Ez pedig azt sugallta, hogy a teljes közösség mindössze néhány egyede szedett össze rezisztenciát okozó mutációt, a többieknek valahogy ezek segítenek túlélni.
De hogyan? A legkézenfekvőbb megoldás, hogy valami olyan fehérjét szekretálnak, ami a többiek esetében is megnöveli a túlélés esélyét. Némi vizsgálódás után kiderült, hogy valóban akad egy ilyen fehérje, a triptofanáz enzimet kódoló (TnA). A TnA szerepe, hogy a triptofánt ammóniává, piruváttá és indollá alakítsa. Mivel az indol szerepe az E. coli stressz-toleranciájában már korábban is felmerült, ez különösen szembetűnő volt.
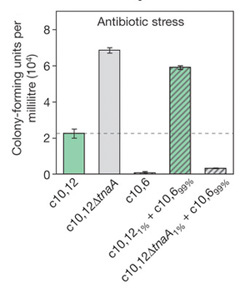 Hogy ellenőrizzék, valóban ilyesmiről van-e szó, egy magas rezisztenciát mutató izolátumból (c10,12) kiütötték az enzimet kódoló tnA gént, majd 1%-99% arányban vegyítették egy rezisztenciát nem hordozó izolátummal (c10,6). A mixet olyan antibiotikum koncentráció mellett próbálták nevelni, amit az utóbbi már nem tolerált.
Hogy ellenőrizzék, valóban ilyesmiről van-e szó, egy magas rezisztenciát mutató izolátumból (c10,12) kiütötték az enzimet kódoló tnA gént, majd 1%-99% arányban vegyítették egy rezisztenciát nem hordozó izolátummal (c10,6). A mixet olyan antibiotikum koncentráció mellett próbálták nevelni, amit az utóbbi már nem tolerált.
Az eredmény elég meggyőző: ha a sejtek kis százaléka képes TnA-t termelni, az a többiek fennmaradását segíti, míg ha nem képes, akkor hiába hordozzák a rezisztenciát a többieken ez nem segít.
A megfigyelés egy másik érdekessége, hogy a deléciót hordozó rezisztens populáció jóval jobban tudott növekedni, mint a rezisztenciát hordozó, de TnA-t is termelő baktériumok, vagyis az enzim termelése jól mérhető fitnesz-csökkenést okozott.
Vagyis az egyszeri megfigyelő mikrobiális altruizmusnak lehet a tanúja. Az antibiotikum-kezelés normális esetben a sejtek halálát okozná, de ha néhány egyedben kialakul a rezisztencia, ezek saját energiájuk egy részét TnA szekretálásra fordítják (egyébként ezt alapfelállásban minden sejt megteszi). Az enzim indolt hoz létre a tápoldatban, az indol pedig bejutva a nemrezisztens társakba olyan mikrobiálisolekuláris pumpák számát fogja fokozni (pl. MdtE), amelyek válogatás nélkül mindenféle idegen anyagot kinyomnak a sejtből, ezzel csökkentve a toxikus antibiotikum koncentrációt.
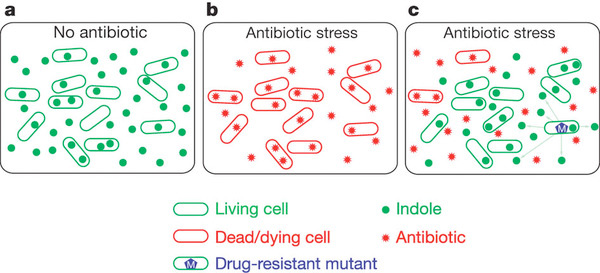
A rendszer látszólag ellentmond a rideg, evolúciós józan észnek, hiszen a rezisztens baktériumnak illetve utódainak kompetitív előnye van a többiekhez képest, így ezt megragadva gyorsan ki kellene szorítaniuk azokat. Hogy az "altruizmusnak" mi lehet mégis az értelme, arra két hipotézist állíthatunk fel és mindkettőhöz jó észben tartani, hogy a nem-rezisztens társak is közeli rokonai a rezisztens izolátumokban fellelhető baktériumoknak, így előbbiek fennmaradása egy szinte tökéletesen megegyező genetikai anyag fennmaradását is jelenti egyben. Az egyik elgondolás szerint, a nagyobb életben maradó populációban nagyobb eséllyel jelennek meg újabb, esetleg még kedvezőbb rezisztencia-mutációk, ha arra jut elég idő. A másik felvetéshez pedig azt kell észben tartani, hogy a rezisztenciának általában fitnesz-ára van. Azért nem rezisztens csuklóból minden baktérium minden antibiotikumra, mert a rezisztenciát kiváltó mutáció antibiotikum-mentes körülmények közt hátrányt jelent. Így, ha a stressz csak átmeneti, a nem rezisztens egyedek túlélése azt jelentheti, hogy a populáció hamarabb vissza tud állni a régi kerékvágásba, a veszély elmúltával.
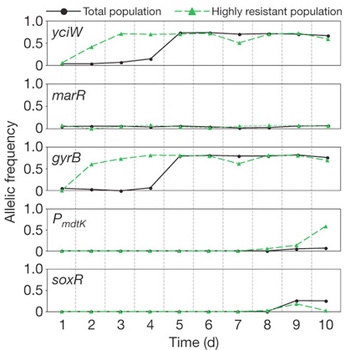 Persze, ha az antibiotikum csak nem akar eltűnni a közegből, akkor végül az mégis csak a rezisztencia-allél térnyeréséhez vezet, hiszen az ezt hordozó baktériumok összességében valamivel csak sikeresebbek.
Persze, ha az antibiotikum csak nem akar eltűnni a közegből, akkor végül az mégis csak a rezisztencia-allél térnyeréséhez vezet, hiszen az ezt hordozó baktériumok összességében valamivel csak sikeresebbek.
De ha a kísérlet során megjelenő különböző rezisztencia-mutációk allélgyakoriságát figyeljük, szembetűnik, hogy ez az érték (az adott körülmények között) szinte sosem lesz 1 - vagyis nem fogja a kultúra minden egyede hordozni -, esetenként pedig kifejezetten alacsony marad.
(A félreértések végett érdemes megjegyezni, hogy a rezisztencia-mutációk nem kacsolódnak a TnA-indol rendszerhez, hanem a norfloxacin által megcélzott fehérjéket kódoló génekben jelentek meg.)
(A baktériumos rajz innen származik.)
Lee HH, Molla MN, Cantor CR, Collins JJ (2010) Bacterial charity work leads to population-wide resistance. Nature 467: 82-85.