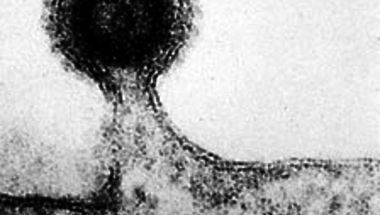
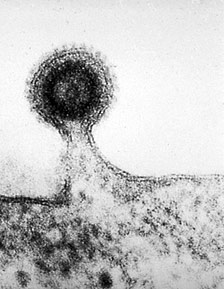
 A "9173 bázispár a halál" felütéssel indított poszt talán kellően semmitmondó és felületes, hogy sokan rákattintsanak, ugyanakkor mégsem teljesen pontatlan: figyelembe véve, hogy az
AIDS mekkora pusztítást végez a HIV fertőzöttek körében, nem túlzás azt mondani, hogy ma a világ nagyobb részén a fertőzés elég gyors és bizonyos utat jelent a halálba.
A "9173 bázispár a halál" felütéssel indított poszt talán kellően semmitmondó és felületes, hogy sokan rákattintsanak, ugyanakkor mégsem teljesen pontatlan: figyelembe véve, hogy az
AIDS mekkora pusztítást végez a HIV fertőzöttek körében, nem túlzás azt mondani, hogy ma a világ nagyobb részén a fertőzés elég gyors és bizonyos utat jelent a halálba.
A napokban/hetekben a HIV kutatás két igen fontos felfedezést könyvelhetett el: egyrészt megfejtették a vírus RNS genomjának másodlagos szerkezetét, másrészt bebizonyosodott, hogy a régi dogma, miszerint a rokon SIV vírussal fertőzött csimpánzok nem betegek, valójában nem több mint városi legenda.
A HIV egy tipikus retrovírus, azaz genomja RNS alapú (a vírus részecskében a genomi RNS lánc két példányban van jelen), és csak a fertőzés után, immár a sejten belül, íródik át DNS-é (a vírus által biztosított reverz transzkriptáz - RT - enzim segítségével), ill. integrálódik a sejt saját genomjába (szintén egy virális enzim, az integráz - IN - aktív közreműködésével).
 A "9173 bázispár a halál" felütéssel indított poszt talán kellően semmitmondó és felületes, hogy sokan rákattintsanak, ugyanakkor mégsem teljesen pontatlan: figyelembe véve, hogy az
AIDS mekkora pusztítást végez a HIV fertőzöttek körében, nem túlzás azt mondani, hogy ma a világ nagyobb részén a fertőzés elég gyors és bizonyos utat jelent a halálba.
A "9173 bázispár a halál" felütéssel indított poszt talán kellően semmitmondó és felületes, hogy sokan rákattintsanak, ugyanakkor mégsem teljesen pontatlan: figyelembe véve, hogy az
AIDS mekkora pusztítást végez a HIV fertőzöttek körében, nem túlzás azt mondani, hogy ma a világ nagyobb részén a fertőzés elég gyors és bizonyos utat jelent a halálba.
A napokban/hetekben a HIV kutatás két igen fontos felfedezést könyvelhetett el: egyrészt megfejtették a vírus RNS genomjának másodlagos szerkezetét, másrészt bebizonyosodott, hogy a régi dogma, miszerint a rokon SIV vírussal fertőzött csimpánzok nem betegek, valójában nem több mint városi legenda.
A HIV egy tipikus retrovírus, azaz genomja RNS alapú (a vírus részecskében a genomi RNS lánc két példányban van jelen), és csak a fertőzés után, immár a sejten belül, íródik át DNS-é (a vírus által biztosított reverz transzkriptáz - RT - enzim segítségével), ill. integrálódik a sejt saját genomjába (szintén egy virális enzim, az integráz - IN - aktív közreműködésével).
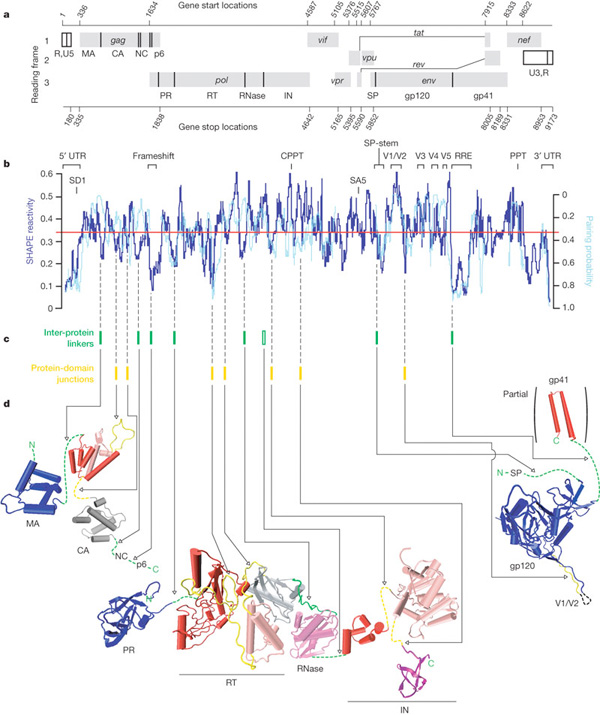
A teljes életciklusához, a vírus lényegében 15 saját fehérjét használ fel (a számos gazda enzim mellett), amelyek részben az előbb említett integrációt biztosító enzimeket kódolják, részben azokat a fehérjéket (p17, p24), amelyek a viroid burkát hozzák létre a sejten kívüli élethez, ill. ezen a burkon azokat a fehérjeláncokat (gp120, gp41), amelyek az újabb fertőzést majd lehetővé teszik.
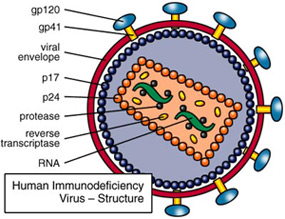 Külön érdekesség, hogy a 15 fehérjét mindössze 9 leolvasási keret (ún. open reading frame - ORF) biztosítja, vagyis több esetben is egy nagy polipeptid darabolódik kisebbekre (gyakran még transzláció során). Ilyen pl. a gag gén kódolta polipeptid, amelyből a strukturális mátrix (MA), kapszid (CA), nukleokapszid (NC) és p6 fehérjék alakulnak ki, az ún. gag-pol gén, amelynek termékéből RT és IN mellett egy proteáz (PR) készül, valamint az env gén, amely a gp120 és gp41 előtt egy egy szignál peptidet kódol. Utóbbinak az a feladata, hogy az ún. szignál felismerő részecskéhez (signal recognition particle) kapcsolódjon, amely az egész transzlációs masinériát, riboszómástól, mindenestől a durva endoplazmatikus retikulumba szállítja, ahol aztán sor kerül a gp120 és gp41 transzlációjára. Ha pedig már gp120, akkor szót kell ejteni a molekula egyik jellegzetes tulajdonságáról, arról, hogy több igencsak változékony régióval rendelkezik, ami egyúttal lehetővé is teszi, hogy az immunrendszert kijátssza. A változékonyság RNS szinten van kódolva, ugyanis a megfelelő kódoló régiók a HIV genom legváltozékonyabb részei közé tartozó ún. hipervariábils régiók (V1-5).
Külön érdekesség, hogy a 15 fehérjét mindössze 9 leolvasási keret (ún. open reading frame - ORF) biztosítja, vagyis több esetben is egy nagy polipeptid darabolódik kisebbekre (gyakran még transzláció során). Ilyen pl. a gag gén kódolta polipeptid, amelyből a strukturális mátrix (MA), kapszid (CA), nukleokapszid (NC) és p6 fehérjék alakulnak ki, az ún. gag-pol gén, amelynek termékéből RT és IN mellett egy proteáz (PR) készül, valamint az env gén, amely a gp120 és gp41 előtt egy egy szignál peptidet kódol. Utóbbinak az a feladata, hogy az ún. szignál felismerő részecskéhez (signal recognition particle) kapcsolódjon, amely az egész transzlációs masinériát, riboszómástól, mindenestől a durva endoplazmatikus retikulumba szállítja, ahol aztán sor kerül a gp120 és gp41 transzlációjára. Ha pedig már gp120, akkor szót kell ejteni a molekula egyik jellegzetes tulajdonságáról, arról, hogy több igencsak változékony régióval rendelkezik, ami egyúttal lehetővé is teszi, hogy az immunrendszert kijátssza. A változékonyság RNS szinten van kódolva, ugyanis a megfelelő kódoló régiók a HIV genom legváltozékonyabb részei közé tartozó ún. hipervariábils régiók (V1-5).
A másodlagos szerkezetet egy viszonylag új módszerrel, a SHAPE reaktivitással határozták meg. Megkerülve a technikai részleteket a lényeg az az alacsony reaktivitás viszonylag bonyolult másodlagos RNS struktúra jelenlétét jelöli, a magas reaktivitás pedig ennek ellentettjét.
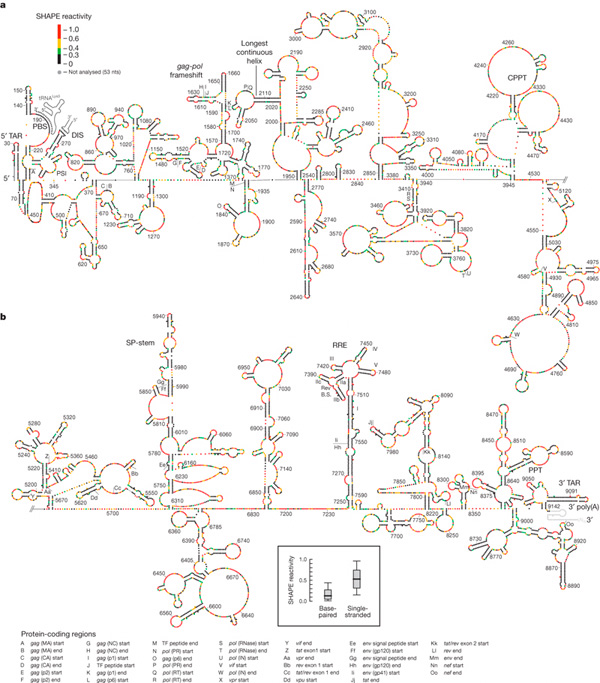
A szerkezet bonyolultáságában már már a riboszomális RNS-ekével vetekszik és két fontos dolgot lehet rajta megfigyelni: a variánilis régiók általában pont nélkülözik a komplex elemeket, ill. azokon a helyeken ahol a polipeptidekben kódolt fehérjék határai találhatók, ill. összetettebb fehérjék (pl. RT) belső doménjeinek a határai, egy-egy helyre kis hurok tűnik fel. Ezeknek minden valószínűség szerint fontos szerepük van: mivel okunk van feltételezni, hogy az RNS genom másodlagos szerkezete jól tükrözi, hogy az integrálódott HIV vírusról átíródó mRNS molekulák szerkezet milyen, ezek a hurkok megtalálhatóak a fehérjeszintézis során felhsznált RNS-ekben is. Az ilyen strukturális elemek pedig megakasztják (ha csak rövid időre is) a transzlációt, ami azért lényeges, mert a már megszintetizált fehérjeláncoknak így van elég idejük felvenni a helyes fehérje konformációjukat és nem szomszédos doméneket kódoló szekvenciák állnak össze valami zagyva egyveleggé.
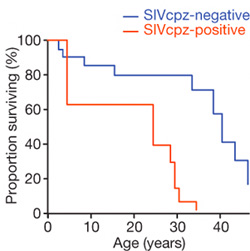 És akkor ugrás a csimpánzokhoz. Mint már korábban említettem, hosszú, hosszú ideig az volt az uralkodó nézet, hogy a majmoknak ugyan megvannak a maga lentivírusai, köztük a SIV is, de hiába származtathatjuk ezekből az emberi HIV-t, ezek a kórokozók nem okoznak az emberi AIDS-hez hasonló megbetegedést emberszabású rokonainkban. A dolog egyetlen szépséghibája, hogy egyetlen szisztematikus tanulmány sem támasztotta ezt alá (igaz, nem is cáfolta meg). Most kutatók egy csoportja visszament a Gombe Nemzeti Parkba, a Jane Goodall által is tanulmányozott csimpánzcsoportot vette jobban szemügyre. Az eredmény pedig elég egyértelműen cáfolja napjaink konszenzusát. A SIV-el fertőzött csimpánzok kevesebb ideig élnek, mint egészséges társaik, valamint lényegesen kevesebb utódot is nemzenek. Nem mellékesen a vírus fertőzés horizontális (szexuális úton történő) átadása mellett az ún. vertikális (terhes anyából magzatjára) fertőződést is feljegyeztek, vagyis a kór terjedési paraméterei kísértetiesen hasonlítanak az emberi fertőzésére.
És akkor ugrás a csimpánzokhoz. Mint már korábban említettem, hosszú, hosszú ideig az volt az uralkodó nézet, hogy a majmoknak ugyan megvannak a maga lentivírusai, köztük a SIV is, de hiába származtathatjuk ezekből az emberi HIV-t, ezek a kórokozók nem okoznak az emberi AIDS-hez hasonló megbetegedést emberszabású rokonainkban. A dolog egyetlen szépséghibája, hogy egyetlen szisztematikus tanulmány sem támasztotta ezt alá (igaz, nem is cáfolta meg). Most kutatók egy csoportja visszament a Gombe Nemzeti Parkba, a Jane Goodall által is tanulmányozott csimpánzcsoportot vette jobban szemügyre. Az eredmény pedig elég egyértelműen cáfolja napjaink konszenzusát. A SIV-el fertőzött csimpánzok kevesebb ideig élnek, mint egészséges társaik, valamint lényegesen kevesebb utódot is nemzenek. Nem mellékesen a vírus fertőzés horizontális (szexuális úton történő) átadása mellett az ún. vertikális (terhes anyából magzatjára) fertőződést is feljegyeztek, vagyis a kór terjedési paraméterei kísértetiesen hasonlítanak az emberi fertőzésére.
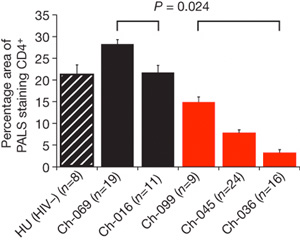 Végül, de nem utolsó sorban arra is fény derült, hogy a vírus okozta fiziológiás változások sokba emlékeztetnek az emberi AIDS-re. A vérképre jellemző a CD4+ T fehérvérsejtek számának drámai lecsökkenése (a baloldali ábrán a fekete oszlopok az egészséges egyedek CD4 számát jelölik, a pirosak pedig a betegekét), ami az immunválasz megrendüléséhez vezet és lehetővé teszi, hogy az egészséges emberek számára könnyen túlélhető kisebb betegségek a HIV fertőzött életébe kerüljenek.
Végül, de nem utolsó sorban arra is fény derült, hogy a vírus okozta fiziológiás változások sokba emlékeztetnek az emberi AIDS-re. A vérképre jellemző a CD4+ T fehérvérsejtek számának drámai lecsökkenése (a baloldali ábrán a fekete oszlopok az egészséges egyedek CD4 számát jelölik, a pirosak pedig a betegekét), ami az immunválasz megrendüléséhez vezet és lehetővé teszi, hogy az egészséges emberek számára könnyen túlélhető kisebb betegségek a HIV fertőzött életébe kerüljenek.
A felfedezés önmagában persze nem jelenti az AIDS azonnali gyógyítását, ugyanakkor mégsem jelentéktelen. Mivel a vírus már hosszú ideje "együtt él" a csimpánzokkal, jó esélyünk van arra, hogy több populációt tanulmányozva természetes rezisztenciát (vagy legalább részleges védettséget) okozó mutációkat fedezünk fel amelyek viszont már tényleg közelebb vihetnek egy emberi gyógymód kifejlesztéséhez.
(Felhasznált képek forrásai: UChicago ill. helpcure.com.)
Watts JM, Dang KK, Gorelick RJ, Leonard CW, Bess JW Jr, et al. (2009) Architecture and secondary structure of an entire HIV-1 RNA genome. Nature 460: 711-716.
Keele BF, Jones JH, Terio KA, Estes JD, Rudicell RS, et al. (2009) Increased mortality and AIDS-like immunopathology in wild chimpanzees infected with SIVcpz. Nature 460: 515-519.