 Bő tíz éve szinte véletlen megfigyelésekből indult a dolog és mára a biológia egyik legizgalmasabb területévé vált az RNS-függő génexpresszió-szabályozás tanulmányozása. Felfedezőinek máris Nobel díjat hozott, az alkalmazott kutatóknak új esélyt, hogy eddig gyógyíthatatlan betegségekkel elbánjanak, az alapkutatóknak pedig egy jó kis játékszert, hogy kedvenc élőlényeik belső működését jobban megismerjék.
Bő tíz éve szinte véletlen megfigyelésekből indult a dolog és mára a biológia egyik legizgalmasabb területévé vált az RNS-függő génexpresszió-szabályozás tanulmányozása. Felfedezőinek máris Nobel díjat hozott, az alkalmazott kutatóknak új esélyt, hogy eddig gyógyíthatatlan betegségekkel elbánjanak, az alapkutatóknak pedig egy jó kis játékszert, hogy kedvenc élőlényeik belső működését jobban megismerjék.
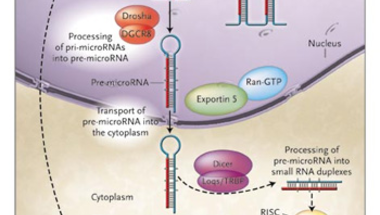
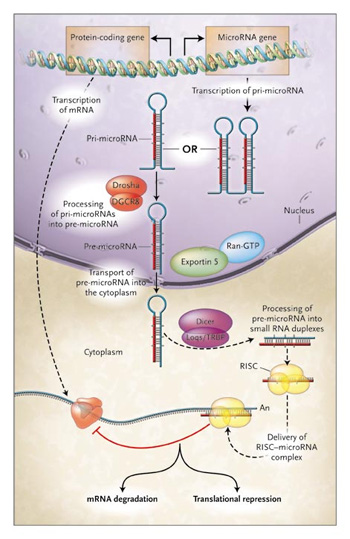
A jelenség legismertebb formája az ún. RNS-interferencia, amelynek röviden az a lényege, hogy ha fehérjévé való lefordítása előtt/során, egy-egy adott génről átíródó mRNS olyan rövid (szintén RNS) molekulákkal találkozik, amelyek kb 20-25 bp hosszan kapcsolódni tudnak hozzá (vagyis komplementerek vele), akkor egy az így keletkező kétszálú RNS beindít egy molekuláris gépezetet, amely végül az mRNS lebomlásához vezet.
Ezt a masinériát használja a sejt maga is saját szabályozási folyamatai során, pl. a mikroRNS-ekkel (miRNS) kapcsolatban. A miRNS gének maguk kódolják a fent említett apró RNS szakaszokat (amelyek egy hosszabb és bonyultabb térbeli szerkezetű molekula fedlogozása során jönnek létre, lásd jobb oldalt), s így hozzájárulnak egyes fehérjekódoló gének átíródásának megregulázásához. Az így szabályozott fehérjékből kevesebb, vagy semennyi sem keletkezik azokban a sejtekben, amelyek egyben a miRNS-t is tartalmazzák.
Potens és elegáns módja ez a génexpresszió szabályozásának (igazából szinte az a csoda, hogy csak tíz éve jöttek rá, hogy mi is történik), nem meglepő hát, hogy jópár kutatóban az is felmerült, hogy ha a miRNS-ek révén "finomhangolt" rendszerek sokkal hatékonyabban tudnak működni, megjelenésüknek egyben evolúciós előnye lehet.
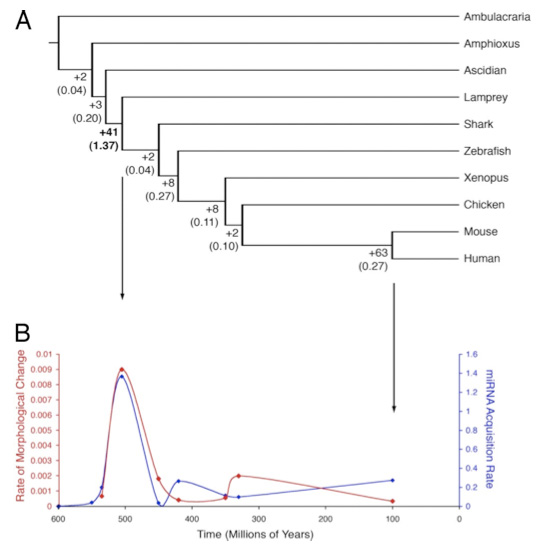
Ezt látszik alátámasztani az a napokban megjelent cikk is, ahol néhány fontosabb állatcsoport képviselőit megvizsgálva azt találták, hogy a komolyabb morfológiai változások és a miRNS családok száma között komoly összefüggés mutatkozik a gerincesek kialakulásának vonatkozásában. Ennek a változásnak egy részét tradicionálisan a kulcspillanatokban (pl. állkapocsnélküli vs. állkapcsos gerincesek) végbement genomduplikációhoz köti a tudományos irodalom, ami logikusnak látszik, hiszen duplikáció után az "új" gének, új kontextusokban, új feladatok megoldására specializálódhatnak. Sőt, felületesen nézve a genomduplikáció egyben magyarázatot adhat a miRNS gének számának növekedésére is. A gond csak, hogy a miRNS családok számának bővülése, nem meglévő gének duplikációjához vezethető, hanem teljesen új családok megjelenéséhez. Vagyis, könnyen lehet, hogy sok morfológiai változás már meglevő gének dózisának és kifejeződési helyének pontosabb szabályozásához kapcsolható, és nem csak új (vagy már meglevő) fehérjék új funkcióihoz.
Stefani G, Slack FJ (2008) Small non-coding RNAs in animal development. Nat Rev Mol Cell Biol 9(3): 219-230.
Heimberg AM, Sempere LF, Moy VN, Donoghue PC, Peterson KJ (2008) MicroRNAs and the advent of vertebrate morphological complexity. PNAS 105(8): 2946-2950.