A La vida loca nevű osztrák honlap blogján (amihez Daniela Pfeifer dietetikus mellett Dr. Ingo Paulsen biológus, Steffen Schalk fitness- és egészség-coach, valamint Mia Schöbel LifeCoach adja a nevét) idén februárban megjelent egy bejegyzés Steffen, az egészségguru tollából, ami a ketogén étrend rákos betegeket érintő hatásáról szól, és utal arra, hogy a Würtzburgi Egyetem egy külön betegtájékoztatót is adott ki (még 2011-ben) a témával kapcsolatban. Az osztrák média az uborkaszezonban felkapta ezt a témát, így jutott el végül hozzánk hétfőn az a futótűzszerűen terjedő szenzációs hír, miszerint a Würtzburgi Egyetem kutatói azt állítják, hogy a cukormentes, vagyis ketogén diéta kiéhezteti a rákos sejteket. Megtudhattuk még továbbá azt is, hogy „az egészséges sejtnek egy, a rákosnak 30 inzulinreceptora van. Energiájuk nagy részét nem képesek a sejtlégzés vagy a zsírok lebontása révén felvenni, mint az egészséges sejtek, ezért cukorfüggők", valamint, hogy „a cukor emésztésekor nagy mennyiségű tejsav is keletkezik, amely védi a daganatos sejteket és gyengíti az épeket, ezáltal lehetővé teszi, hogy a betegség tovább terjedjen a környező szövetekbe.”

Számos hírportál egy az egyben vette át a hírt, ami a szakmai újságírás csődjének egyik iskolapéldája. Mielőtt azonban tételesen átnéznénk a kiemelt mondatokat, lássuk, mi is az a ketogén diéta.
A ketogén étrend vészesen kevés szénhidrát, ellenben sok telítetlen zsírsav és fehérje bevitelén alapul. Ez alatt a diéta alatt a szervezet valójában ugyanazokon a hormonális és anyagcsere-változásokon megy keresztül, mint amikor éhezik, csak nem a saját fehérjéit és zsírsavait bontja, hanem azt, amit az illető megeszik. Ha nem jut elég szénhidrát a szervezetbe, a vér állandó cukorszintjét először a májban lévő glikogénraktárak lebontása biztosítja. Ha e raktár kiürül, akkor - a vércukorszintet biztosítandó - a máj újonnan szintetizál glükózt, amihez a fehérjékből származó aminosavak és a zsírsavakból származó lipidek bontása szolgáltat alapanyagot. A ketogén diétára átálló és az éhező ember szöveteinek nagy része (az agyat, a legnagyobb glükózfelvevőt kivéve) ebben a stádiumban (az éhezés illetve a diéta 24-72. órájában) a glükóz helyett a szabad aminosavakat használja energiaforrásként. Ekkor kezd a májban fokozódni a ketogenezis. Ez az a folyamat, amikor a májban a zsírsavak lebontásakor ketontestek, vagyis béta-hidroxi-vajsav, acetecetsav és aceton (ez utóbbit a tüdő is kiválasztja, vagyis az acetonszagú lehelet a ketogenezis egyik indikátora) keletkeznek. Ezeket a májsejtek nem tudják tovább bontani, így a ketontestek a véráramba kerülnek. Itt szeretném felhívni a diétamániások és lúgosítók szíves figyelmét arra, hogy mind a béta-hidroxi-vajsav és az acetecetsav igencsak savas kémhatású, így ha ezekből több keletkezik (és kerül be a véráramba), mint amennyit a sejtek aktuálisan felvesznek, ténylegesen megvalósul a lúgosítók rémálma, és a vér pH-ja eltololódhat a savas irányba, és sajnos ezen a Fürdei víz ivása sem változtat. A diéta és az éhezés következő fázisában a vízoldékony ketontestek koncentrációja eléri azt a szintet, amelynél az idegsejtek is képesek ketontestek oxidációjából fedezni az energiaszükségletük egy részét, így az agy glükózfelhasználása mintegy a felére csökken. Figyelem, ez nem jelenti azt, hogy az agy teljesen függetleníti az anyagcseréjét a glükóztól, és azt sem, hogy a vérben ne lenne vércukor. Ha a diéta esetén a bevitt fehérjék és aminosavak mennyisége nagyobb, mint amennyire a szervezetnek szüksége van, az izmok és szervek nem károsodnak, vagyis ez a diéta elvben egy ideig fenntartható. Ennek ellenére ez az étrend igencsak drasztikus és nem veszélytelen, hiszen a túlzott fehérje- és zsírbevitel szénhidrátbevitel nélkül tényleg felboríthatja a vér pH-ját, ha viszont nem elegendő a fehérjebevitel, akkor a szervezet a könnyen mozgósítható izomfehérjéket kezdi bontani. Ezen felül a nagy mértékű zsírbevitel (a 4:1 zsiradék:fehérje+szénhidrát arány igen nagynak számít) káros hatással lehet a szív- és érrendszerre, továbbá a diéta alatt vitamin- és ásványi anyag hiány léphet fel, illetve megnő a vesekő, vérszegénység illetve csontritkulás kialakulásának esélye.
Hogy ténylegesen mit is jelent a ketogén diéta, álljon itt egy kis táblázat a http://www.taplalkozasdieta.hu/ketogen-dieta oldalról:
Nyersanyagok alkalmazhatósága ketogén diétában
|
Nagy mennyiségben fogyasztható |
Mérsékkel, számolva fogyasztható |
Nem javasolt fogyasztásra |
|
Zsiradékok: |
Zöldségfélék: |
Zöldségfélék: |
dr Dr. Hugh Conklin a múlt század elején Amerikában hosszan tartó böjttel és imádsággal hihetetlen hatást ért el epilepsziás gyerekeknél, sokak rohamai teljesen vagy részlegesen megszűntek. Az 1920-as évektől kezdve (amikor rájöttek az éhezés fizilógiás hatásaira) a böjtöt felváltotta a magas zsírtartalmú és alacsony szénhidrát-tartalmú diéta, ami ugyanúgy működött, mindenfajta vallásos áhítat nélkül is. Az epilepsziaellenes gyógyszerek megjelenése kiszorította a köztudatból a csodaétrendet, majd a hetvenes években újra felfedezték a diéta epilepsziára gyakorlolt áldásos hatását, és ma már orvosi kezelésként is alkalmazzák a gyógyszeres kezelésre nem reagáló gyermekkori epileszia esetén. A Johns Hopkins Hospital (JHH) külön ketogén diétás osztállyal rendelkezik, ott foglalkoznak a személyre szabott étrend kórházi beállításával. Egy 150 pácienst érintő vizsgálat alapján a minimum 3 hónapos, maximum kétéves diéta hatására egy évvel a kezelés megkezdése után a JHH által kezelt gyerekeknek 7%-a szabadult meg teljesen a rohamoktól, 31%-uknak több, mint 90%-os volt a javulása, és durván a negyedük 50-90%-os javulást ért el [1].
Mivel nem számít igazán egészséges étrendnek, és betartani sem könnyű, nem túl gyakran ajánlották a dietetikusok sem a ketogén étrendet (legfeljebb epilepszia esetén), míg a kétezres évek elején divatba nem jött Amerikában. Azóta sok „szakértő” szerint ideális fogyásra és most már a rák ellenszereként is ismert, hazánkban Szendi Gábor is megemlékezik e diéta rákmegelőző illetve –kezelő hatásáról.
Ennek örömére nézzük akkor át, mi is igaz a tumorsejtek cukorfüggőségéből, illetve abból, hogy a cukormegvonás rákellenes hatású. Az 1910-es években Otto Warburg által végzett kísérletekre hivatkoznak azok, akik a ráksejtek falánkságát és nagy cukorigényét hirdetik. Warburg vékony szövetmetszetek energiafelhasználását vizsgálva azt tapasztalta, hogy a humán karcinómasejtek glükózból leginkább tejsavat állítanak elő (még jó oxigénellátottságú körülmények között is), míg a normál sejteket tartalmazó metszetekre az oxidatív foszforiláció a jellemző. Ezt a jelenséget, amely Warburg-effektusként is ismert, manapság úgy interpretálják, hogy a tumorsejtek (a mitokondriumok károsodását nevezve meg okként) képtelenek a biológiai oxidáció terminális oxidációs lépésére, ami a tejsavas erjesztésnél egy nagyságrenddel hatékonyabb energetikailag, így ugyanannyi energia termeléséhez legalább egy nagyságrenddel több cukrot kell fogyasztaniuk, mint a normál sejteknek. Nos, ez a megállapítás sajnos nem igaz. A Warburg által is vizsgált tumorszövetek is képesek voltak a glikolízis utáni tejsavas erjesztéssel párhuzamosan az oxidatív foszforilációra, de - Warburg leírása alapján - mialatt egy glükózmolekula teljes oxidációja lezajlott, tíz glükózmolekulát alakítottak át tejsavvá. Ennek az az oka, hogy a rákos sejtekben felgyorsul a glikolízis, és a túlzott mennyiségben keletkező piroszőlősavat (illetve acetil-koenzim A-t) nem tudja a citromsav ciklus felvenni, így a feleslegből tejsav képződik. (A tejsav amúgy egyáltalán nem mérgező a sejtek számára – gondoljunk csak a tejsavat termelő, a bél vagy a hüvely nyálkahártyáján élő baktériumokra, vagy az izomláz során keletkező tejsavra. A keletkező tejsav egyébként a sejtekből a vérbe kerül, majd a vesekéreg és a vörös izomrostok felveszik és átalakítják piroszőlősavvá, ami aztán a citromsav ciklusban felhasználódik, illetve a májban glükózzá alakul.) Mindennek semmi köze a mitokondriumok épségéhez, a jelenség hátterében igazából az áll, hogy a glikolízis szabályozásában kulcs szerepet játszó molekulákat tumorszupresszor és onkogén fehérjék képesek befolyásolni (ezek olyan fehérjék, melyek ha mutáció révén elromlanak, sok esetben a sejtek rákos transzformációjához vezetnek). Egészséges sejtekben oxigén jelenlétében gátlódik a piroszőlősav tejsavvá alakulása. E Pasteur effektusnak nevezett folyamat rákos sejtekben nem működik, többek között a hipoxia-indukált faktor (HIF) aktiválódása miatt – a sejtanyagcserét befolyásoló tumorszupresszorok és onkogének egy része (AKT, Ras, p53) a HIF aktiválódását idézik elő [2].
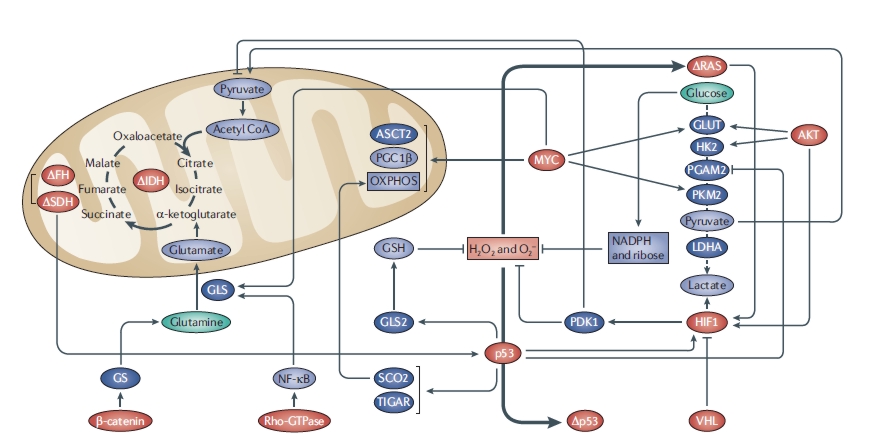
A sejtlégzésen kívül glükózra számos egyéb folyamatban van szükség, glükóz az elsődleges szénforrás a nukleinsav-, aminosav-, lipid- és cukorszintézisben. Nem csoda tehát, hogy az osztódó (akár egészséges, akár rákos) sejtek több tápanyagot igényelnek a sejtek növekedésének és a sejtalkotók előállításának biztosítására, így több cukrot vesznek fel, mint mondjuk egy véglegesen differenciálódott, osztódó sejtet alig tartalmazó szövet sejtjei. Ám egy tumor kialakulása egy igen érdekes többlépcsős folyamat, mely során előfordul olyan állapot, amikor a daganat akkorára nő meg, hogy az eredeti szövet beerezettsége nem tudja biztosítani számára a megfelelő mennyiségű oxigént és táplálékot. Míg a tumorban meg nem kezdődik az angiogenezis, vagyis az új erek kialakulása, addig is a glükóz- és oxigénhiánnyal a rákos sejtek képesek megbirkózni, mégpedig úgy, hogy a sejtszintű stressz esetén aktiválódó szerin-treonin kináz, az AKT foszforilálódik [3]. Egy idei tanulmány szerint kétféle lehet az AKT foszforilációja (más aminosav foszforilálódik) attól függően, hogy rövid- vagy hosszútávú a glükózhiány. Az Oncogen című folyóiratban megjelent cikk szerint a fenntartott tápanyaghiány egy speciális, több fehérjéből álló komplexet eredményez, amely az AKT 308-as treoninjának foszforilációjához vezet, ami egy olyan szignál transzdukciós kaszkád beindulásához vezet, aminek hatására a rákos sejtek a metabolikus stresszt képesek túlélni [4].
Az AKT fehérje az inzulin és az inzulinszerű növekedési hormon (IGF-I és IGF-II) jelátvitele során is aktiválódik [5]. Az inzulint a sejtek felszínén megkötő receptornak (inzulin receptor - IR) két izoformája ismeretes. Az IR-A elsősorban az embrionális fejlődés során expresszálódik, illetve felnőttekben az agyban és különböző rákos sejtekben. Ez a receptorvariáns képes mind az inzulin, mind az IGF-II megkötésére. A normál felnőtt, differenciálódott sejtekben az IR-B fejeződik ki, amely a másik variánssal ellentétben csak inzulint képest kötni. Az IGF-I-nek külön saját receptora van, az IGF1R, amelyhez csak és kizárólag ő kötődik, de a rákos sejtek felszínén ez is megtalálható.
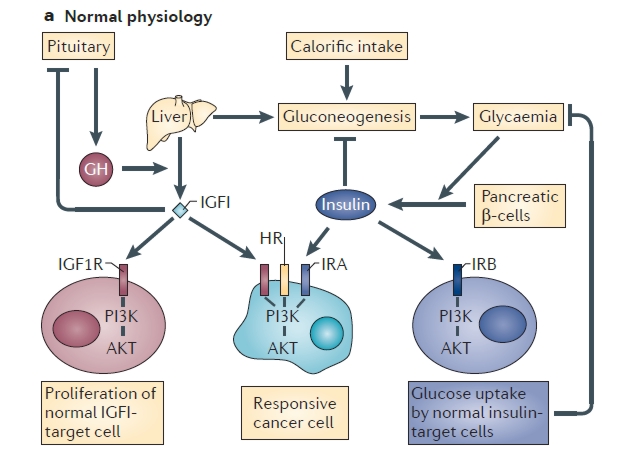
A rákos sejtek felszínén tehát jelen van az IGF-I-et kötő, a normál sejteken is jelen levő IGF1R, valamint a többi nem rákos sejtből hiányzó IR-A, amely mind az inzulint, mind az IGF-II-t képes kötni, így a rendszer mindhárom tagjára képesek reagálni. Néhány tumor esetén kimutatták, hogy a tumorsejtek felszínén több inzulin- vagy IGF-receptor van, mint normál sejteken, de a nagyobb receptormennyiség mögött csak nagyon ritkán áll aktiváló vagy ligand-független aktiváló mutáció. Vagyis lehet, hogy egyes rákos sejtek felületén több az inzulin vagy IGF1R receptor, de azok csak inzulin vagy IGF jelenlétében fejtik ki hatásukat. Az inzulint a hasnyálmirigy béta sejtjei termelik, és mennyisége függ a vérben található glükóz mennyiségétől. Ergo ha lecsökkentjük a táplálékkal bevitt szénhidrát mennyiségét, kevesebb inzulin termelődik, így meg tudjuk akadályozni a rákos sejtek inzulinfüggő cukorfelvételét, valamint az inzulinreceptor (és általa az AKT) sem aktiválódik. Sajnos azonban a rákos sejtek képesek inzulinfüggetlen cukorfelvételre is, valamint a rosszindulatú tumorok egy része képes IGF-II-t termelni. Ilyenkor a daganat képes maga előállítani azt a molekulát, ami aktiválni képes a túlélését biztosító jelátviteli utat, vagyis túlélése független a vér inzulinszintjétől, ezáltal a szervezet cukorfelvételétől [5].
Tehát eddig ott tartanánk, hogy színvonalas, szakmailag magas szintű folyóiratokban megjelent cikkek azt állítják, hogy:
- bár a rákos sejtek oxigéndús környezetben is tejsavat állítanak elő, képesek a normál sejtekre jellemző módon energiát nyerni a glükózból, csak mivel a glikolízis turbó üzemmódban üzemel bennük, a felesleges piroszőlősavat, amit a citromsav ciklus nem tud felvenni, tejsavvá alakítják, és leadják,
- a tejsav nem mérgező sem a rákos, sem az egészséges sejtekre,
- a tumorsejtek jól tolerálják a glükózhiányos állapotot, mivel nem ritka jelenség a glükóz-és oxigénhiány a tumorfejlődés során,
- alacsony szénhidráttartalmú diéta esetén a szervezetben keringő inzulin szintje is alacsony lesz, aminek van biokémiai relevanciája tumorok esetén, hiszen a rákos sejtek egy része több inzulin illetve IGF-receptort hordoz a sejtmembránon, de mivel vannak olyan rákos sejtek, amelyek képesek maguk IGF-II-t termelni, a daganatok egy része képes magát függetleníteni a táplálékfüggő inzulinszinttől,
- a cukormentes étkezés nem jelenti azt, hogy a vérben ne lenne vércukor, a máj ilyenkor zsírok és fehérjék lebontásával próbálja viszonylag állandó szinten tartani a vércukorszintet, vagyis a ráksejtek így is cukorhoz jutnak.
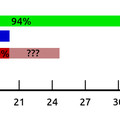
Mindezek alapján nem tartom biokémiailag megalapozottnak azt az állítást, hogy a ketogén étrend negatív hatással van a rákos sejtekre. Na de lássuk, mit mond a tapasztalat. A Würtzburgi Egyetemi Kórház 16 személyen végzett egy „pilot study”-t: mindannyian előrehaladott áttétes daganatos megbetegedésben szenvedtek, és más, konvencionális kezelésre már nem volt lehetőségük. A 16 páciensből végül 5 vett részt a teljes három hónapos ketogén diétás kezelésben. Ők mindannyian jobban érezték magukat érzelmileg a kezelés után, az álmatlanságuk csökkent, míg mellékhatásként csak székrekedést és fáradtságot tapasztaltak az ominózus würtzburgi kiadvány készítői. Végstádiumú áttétes rákos betegeknél talán ennyi is jó eredménynek számítana [6]?
.
Az első ábra forrása: http://www.foodandwine.hu/
1. Hartman, A.L. and E.P. Vining, Clinical aspects of the ketogenic diet. Epilepsia, 2007. 48(1): p. 31-42.
2. Koppenol, W.H., P.L. Bounds, and C.V. Dang, Otto Warburg's contributions to current concepts of cancer metabolism. Nat Rev Cancer, 2011. 11(5): p. 325-37.
3. Owada, S., et al., Critical role of H2O2 generated by NOX4 during cellular response under glucose deprivation. PLoS One, 2012. 8(3): p. e56628.
4. Gao, M., et al., Site-specific activation of AKT protects cells from death induced by glucose deprivation. Oncogene, 2013.
5. Pollak, M., The insulin and insulin-like growth factor receptor family in neoplasia: an update. Nat Rev Cancer, 2012. 12(3): p. 159-69.
6. Schmidt, M., et al., Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: A pilot trial. Nutr Metab (Lond), 2011. 8(1): p. 54.