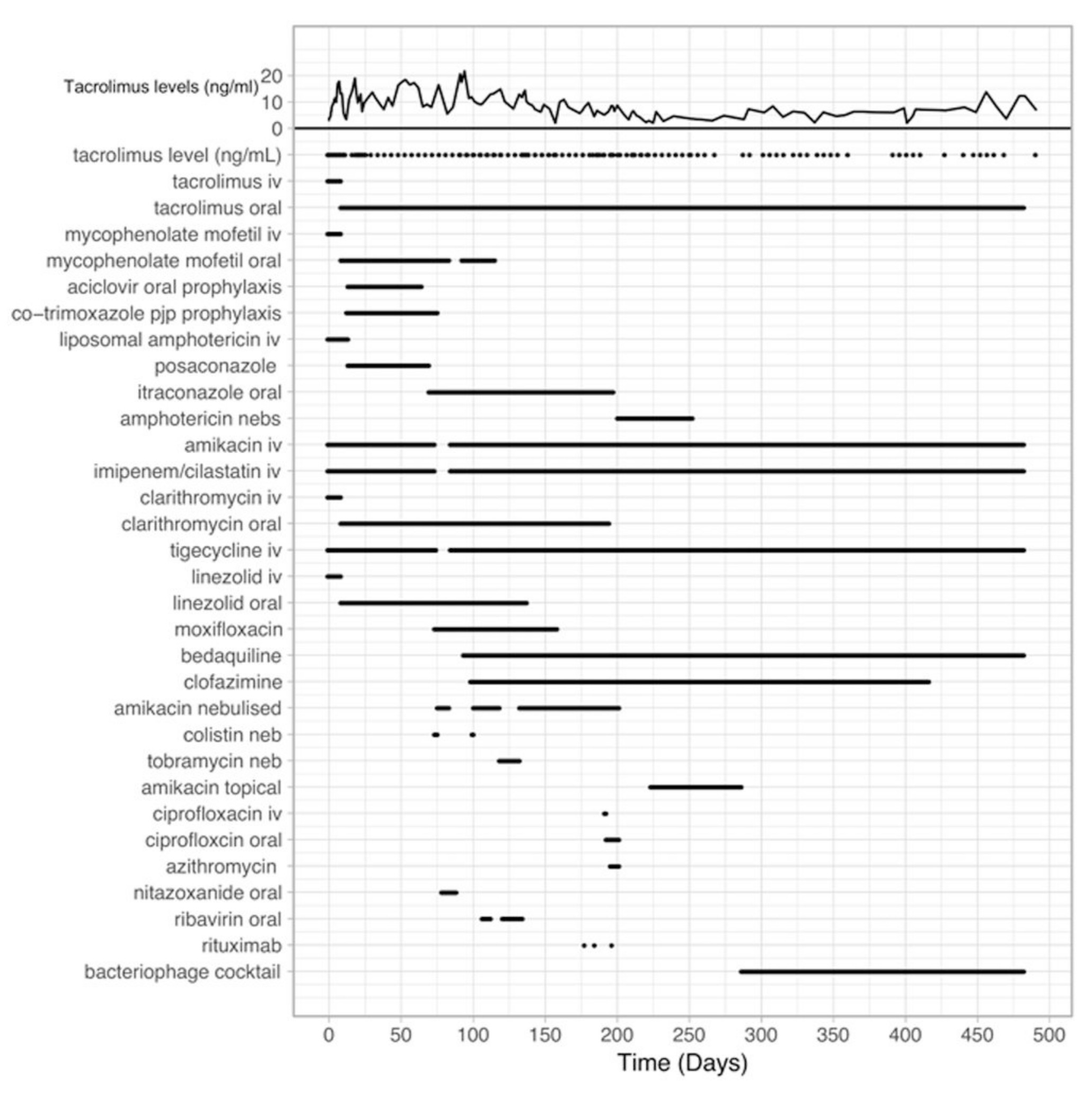
Az első cikkünk, Rebekah M. Dedrick és munkatársai 2019 -es munkája egy klinikai esetleírás, önmagában is izgalmas. A beteg egy tizenöt éves gyerek, aki cisztás fibrózisban szenved, így eleve kifejezetten veszélyeztetett mindenféle fertőzéstől. Az állapota annyira leromlott, hogy tüdőátültetést hajtottak végre rajta, amihez még az immunrendszert gyengítő gyógyszereket is szednie kellett (az első ábrán tacrolimus néven látható az alkalmazása). Azonban a műtéti hegek elfertőződtek, amikből egy Mycobacterium abscessus nevű baktériumot tenyésztettek ki. Innen kezdődött az első ábrán látható kezelés, a vízszintes tengely jelzi az eltelt időt, a függőleges tengelyre pedig följegyezték a gyógyszereket, amikkel a beteget kezelték. Annak ellenére, hogy gyakorlatilag minden szóba jöhető antibiotikumot végigpróbáltak rajta, a beteg állapota romlott, a bőrén mindenhol megjelentek a baktériumfertőzés jelei (a cikkben ugyan találtok erről képet, de én inkább nem mutatnám meg), ekkorra gyakorlatilag tanácstalanul álltak előtte az orvosok.
Ekkor kezdték el fágokkal kezelni. Első lépésként a betegből kitenyésztették az őt fertőző baktériumtörzset, erre hivatkoznak GD01 -ként. Ez nyilván elengedhetetlen, hiszen olyan fágokat szeretnének, amik pont ezt a baktériumot ölik. Ezen kívül beszereztek négy másik M. abscessus törzset, ezekre hivatkoznak GD02-05 ként. A GD02 egy londoni betegből származik, a GD03 Seattleből érkezett, a GD04 Los Angelesből a GD05 pedig Winston-Salemből. Ezek arra kellettek, hogy kiderüljön, mennyire használható a kezelés másik betegeken. Felhasználtak egy másik baktériumot is, az M. smegmatist, ami gyakorlatilag nem kórokozó, biztonságosan dolgozhatnak vele, ám eléggé hasonlít a többi baktériumra ahhoz, hogy az ezt fertőző fágok egy része az emberekben betegséget okozó rokonait is elpusztítsa. Ezt a baktériumot egy, az Egyesült Királyság egyetemein működő programban használják, amely során a környezetből, talajmintákból gyűjtenek új fágtörzseket, amik ezt a nem-kórokozó M. smegmatist nevű baktériumot fertőzik. A céljuk éppen az, hogy olyan fágokat találjanak, amik a nem-kórokozó baktérium rokonait is fertőzik, így gyógyászatban is felhasználhatóak.
A fággyűjtemény a cikk írásakor több, mint tízezer törzset tartalmazott, ebből jó párat végigpróbáltak a betegből származó baktériumtörzsön, végül három olyat találtak, ami hatékonyan ölte a sebekből származó baktériumot. Ez látható a második ábra bal oldalán. A fágok hatékonyságát úgy mérik, hogy egy kocsonyás lemez felületére kenik a baktériumokat, majd egy-egy ponton adott mennyiségű, néhány mikroliternyi fág oldatot oltanak a lemezre. A lemezt melegen tartva a baktériumok elszaporodnak, átlátszatlanná teszik a kocsonyás lemezt, ám ahol a fágok szaporodnak, ott elpusztítják a baktériumokat, így a lemez átlátszó marad. Ezek az ábrán látható fekete foltok, minél több fekete folt keletkezik, annál jobban pusztítja a fág a baktériumokat. Azért oltottak egymás mellé több foltban, mert balról jobbra haladva minden foltra tízszer kevesebb fágot juttattak a lemezre, így összehasonlítható az egyes fágok fertőzőképessége, például az M. smegmatis baktériumpázsiton a ZoeJ fág tízezerszeres hígításban (balról az ötödik folt) már nem egybefüggő tarfoltot képez, csak apróbb foltocskákat, míg a Muddy fág egymilliószoros hígításban (balról a hetedik folt) ad csak apróbb telepeket, ebből látszik, hogy a Muddy sokkal könnyebben fertőzi ezt a baktériumtörzset, mint a ZoeJ.
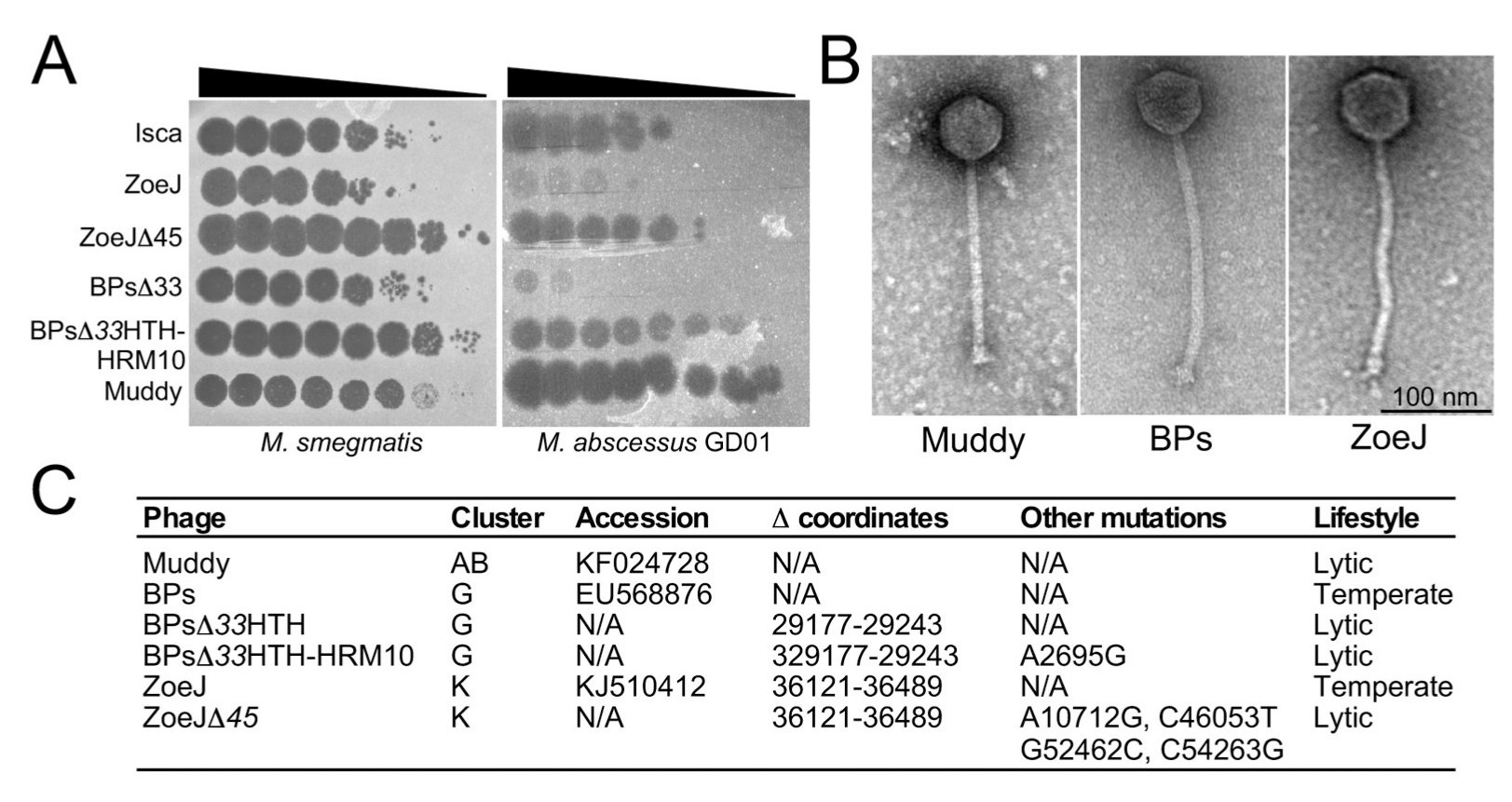
Itt bele is futottak az első nehézségbe: A nem-kórokozó M. smegmatis baktériumot a Muddy a ZoeJ és a BPs fág is meglehetősen jól irtotta, ám amikor kipróbálták őket a betegből származó kórokozón (GD01), akkor bizony egyedül a Muddy működött rendesen, a BPs és a ZoeJ is szerényebb eredményt hozott (a mezei BPs fág eredményeit zavaró módon erre az ábrára nem szerkesztették be). Kicsit közelebbről megnézve a fágokat, erre magyarázatot is találtak: A fágok kétféleképpen szokták fertőzni a baktériumsejteket. Az egyik módszer szerint a fággal fertőzött baktériumsejtek mind szétesnek és fágokat szórnak szét a környezetükbe. A Muddy fág például ilyen. A másik stratégiát követő fágok (ZoeJ és BPs) kis gyakorisággal nem ölik meg a gazdasejtet, hanem a saját genomjukat beépítik a gazda genomjába, ezzel ellenállóvá teszik a gazdasejtet a további saját fágtörzs fertőzésekre (Dedrick és mtsai. 2019b), így ott mintegy elbújva hosszú ideig lappanghatnak, aztán időnként kitörve újabb fertőzéseket okoznak. A vadonban ez a működés előnyös, mivel könnyű belátni, ha egy fág olyan jól működik, hogy minden gazdaszervezetet elpusztít, akkor maga is kihal azonnal, ellenben ha a gazdaszervezetek egy részét megkíméli, biztosítja a saját túlélését is. Ellenben egy ilyen működés emberi gyógyászatban kifejezetten káros, mivel itt éppen az a cél, hogy a beteg szervezetéből minden egyes baktériumsejtet kiirtsanak.
Itt hívták segítségül a genomszerkesztés számos módszerének egyikét (Marinelli és mtsai. 2008): Mivel régóta ismert a fágoknak ez a működése, pontosan tudták, melyik gének szükségesek ahhoz, hogy a fág a saját genomját a gazda genomba illeszthesse. Egyszerűen fogtak egy-egy ehhez szükséges gént és kivágták a fág genomból, így hozták létre a ZoeJΔ45 és a BPsΔ33 törzseket, amik már láthatóan sokkal jobban irtották a betegből származó baktériumokat, mint a vadonból származó őseik, mivel nem tudtak többé elbújni a gazda genomban, hanem minden fertőzött sejtet elpusztítokkak. A BPs fágba még egy pontmutációt is illesztettek, így még harapósabbá tették (ez lett a BPsΔ33HTH-HRM10 törzs), a hígításokból látszik, hogy a génmódosítással százezerszeresen-milliószorosan megnövelték a két fág fertőzőképességét a betegből származó kórokozótörzsön.
Az ábra jobb oldalán a fágokról készült elektronmikroszkópos képek láthatóak, alul pedig egy összefoglaló táblázat az egyes törzsek genomjában eszközölt változtatásokról.
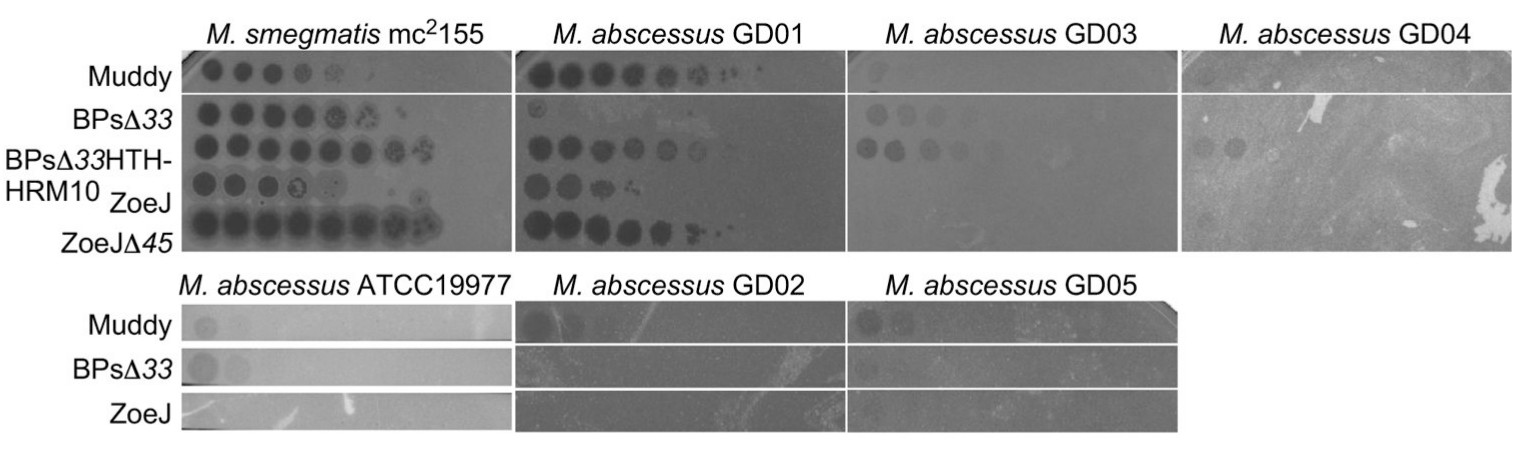
Kísérletképpen kipróbálták az így elkészült fágokat a többi betegből származó kórokozómintákon, ez látszik a következő ábrán. Sajnos az eredmény lehangoló: Az eredetileg Seattle -ben azonosított GD03 kórokozó baktériumot még kis mértékben fertőzte a BPsΔ33HTH-HRM10 fágtörzs, de a többi fág nem boldogult vele a többi kórokozó baktériumtörzs pedig oda se fittyentett egyik fágra sem. Ha ezek fertőznének meg egy beteget, ez a három fág nem hatna rá, az ő esetükben újra ki kellene próbálni jó pár vadonból származó fágtörzset, amíg őket is fertőzőket nem találnak. Ebből úgy tűnik, hogy a módszer nem általános gyógyszer, minden egyes baktériumtörzshöz egyesével kell majd fágtörzseket válogatni.
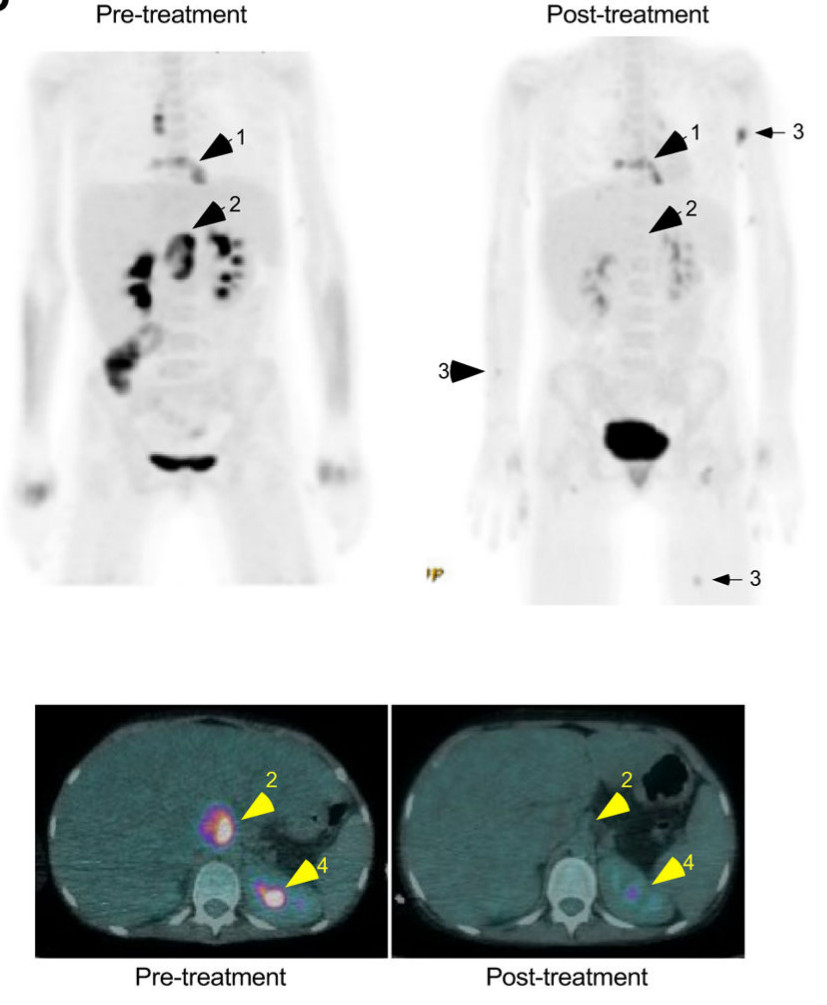
Ezek után a betegnek külsőleg a sebére kenték a három fág keverékét, majd intravénásan adták be a három fágot tizenkét óránként harminckét héten át. A beteg különösebb mellékhatások nélkül viselte a fágkezelést, kilenc nap múlva hazaengedték és otthon folytatta a fágkezelést. Hat hónap alatt csökkentek a tünetei, a következő ábrán látható módon visszaszorult a szervezetében a fertőzés, a megduzzadt nyirokcsomói mérete csökkent. Fölszedett néhány kilót, nőtt a tüdőkapacitása, bár a bőrtünetei nem múltak el nyomtalanul. A bőrön látható foltokból a cikk megírásáig kimutatható volt a kórokozó baktérium, de hat hónap után is érzékeny maradt mindhárom fágtörzsre. Láthatóan gyógyulni kezdett, ami nem kis szó, a cikk szerint a fágkezelés előtt már a palliatív ellátását tervezgették, gyakorlatilag a halálból hozták vissza. Nem találtam róla frissebb közleményt, hogy mi lett vele azóta, bár már egy éve jelent meg a legutolsó cikk.
Újabb dilemma az európai GMO szabályozás hatálya alatt: Ezek ugyanis génmódosított fágok és a kezelés hatására bizony a betegből elég sok ürül belőlük. Érdekes kérdés, hogy egy ilyen kezelés úgy általában az Európai Únióban valaha engedélyeztethető lenne -e? Előre senki sem fogja tudni megmondani, hogy végülis milyen fágokkal kezelik majd a beteget, így előre nem is lehet rá engedélyt kérni. Utólag meg semmi értelme, ha megvannak a hatékony törzsek, a beteg rég meghal, mire végigdöcög az EU évtizedekig tartó engedélyezési eljárása.
Szeretnék a "valódi" sajtóba írni szabadúszóként, de sajnos kívülről bekerülni szinte lehetetlen. Úgyhogy ha újságíró, szerkesztő, laptulajdonos, stb. vagy és szívesen látnád a tudományos ismeretterjesztő cikkeimet a lapodban, bátran keress meg! janoszsambokibio@gmail.com
Dedrick, R. M., Guerrero-Bustamante, C. A., Garlena, R. A., Russell, D. A., Ford, K., Harris, K., ... & Hatfull, G. F. (2019)a. Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus. Nature medicine, 25(5), 730-733.
Marinelli, L. J., Piuri, M., Swigoňová, Z., Balachandran, A., Oldfield, L. M., van Kessel, J. C., & Hatfull, G. F. (2008). BRED: a simple and powerful tool for constructing mutant and recombinant bacteriophage genomes. PLoS One, 3(12), e3957.
Dedrick, R. M., Bustamante, C. A. G., Garlena, R. A., Pinches, R. S., Cornely, K., & Hatfull, G. F. (2019)b. Mycobacteriophage ZoeJ: A broad host-range close relative of mycobacteriophage TM4. Tuberculosis, 115, 14-23.