
Amikor nemrég először kikerült a hírekbe, hogy a francia Rennes-ben folyó gyógyszerkísérlet során hat vizsgálati alanyt kórházba kellett vinni (az egyikük, mint azóta tudjuk, meg is halt), valószínűleg mindenkinek, aki egy kicsit is követi az ilyen híreket, az első szó (karakterkombináció?), ami az eszébe jutott az volt, hogy „TGN1412”.
Utóbbi egy tíz évvel ezelőtti gyógyszerjelölt, amelyet Londonban próbáltak ki, egészen tragikus eredménnyel: egy órával a szer beadás után mind a hat kísérleti alany rosszul lett, hamarosan súlyos légzési zavarjaik alakultak ki, leállt a veséjük, majd végtagjaik keringése, így pár beteg ujjait amputálni kellett. Mindez mindenkit teljesen váratlanul ért, mert a szer egy ún. CD28-szuper ellenanyag, amelynek feladata pont az immunrendszer segítése lett volna bizonyos betegségek (reuma és B-sejtes leukémia) esetében. A vizsgálati alanyok teljesen egészségesek voltak. Ez egy első fázisú gyógyszerkísérlet volt, amikor a szer biztonságát ellenőrizték és hát ennél látványosabban nem lehetett volna belebukni. Azóta eltelt tíz év, és most a rennes-i kísérlet kapcsán feltehetjük a kérdést, hogy levontuk-e a TGN1412 történetéből a megfelelő tanulságokat?
A francia Biotrial cég pont arra szakosodott, hogy különböző fázisú gyógyszerkísérleteket végezzenek, arról gyűjtve adatokat, hogy egy-egy potenciális gyógyszerlapanyag mennyire lehet hasznos illetve veszélyes. Pénteken a portugál Bial cég egyik anyagának (BIA 10-2474) a vizsgálata jutott újabb fázisba és ekkor ment valami nagyon gajra.
A breizh-info-ra kiszivárogtatott információs anyag szerint ez egy elég standard első fázisú vizsgálat lehetett, melynek során a vizsgálati alanyok két hetes ottlétért 1900 euró fizetséget kaphattak. Ezalatt a kísérletben résztvevők, a korábban csimpánzokon is tesztelt gyógyszert tíz, egymást követő nap kapták volna, folyamatos orvosi felügyelet mellett. A gyógyszert eddig már közel kilencven embernek adták be alacsonyabb dózisban, a hat szerencsétlenül járt vizsgálati alany, akiknek az agykérgében később erős vérzést és sejtpusztulást mutattak ki, azok közül voltak az elsők, ahol megemelték a mennyiséget.
A nemzetközi sajtó (majd azt átvéve a hazai is), a jereváni rádió kérlelhetetlen pontosságával „cannabisalapú” gyógyszerről kezdett már akkor beszélni, amikor még alig volt valami információnk az ügyről, mint azóta kiderült, teljesen tévesen.
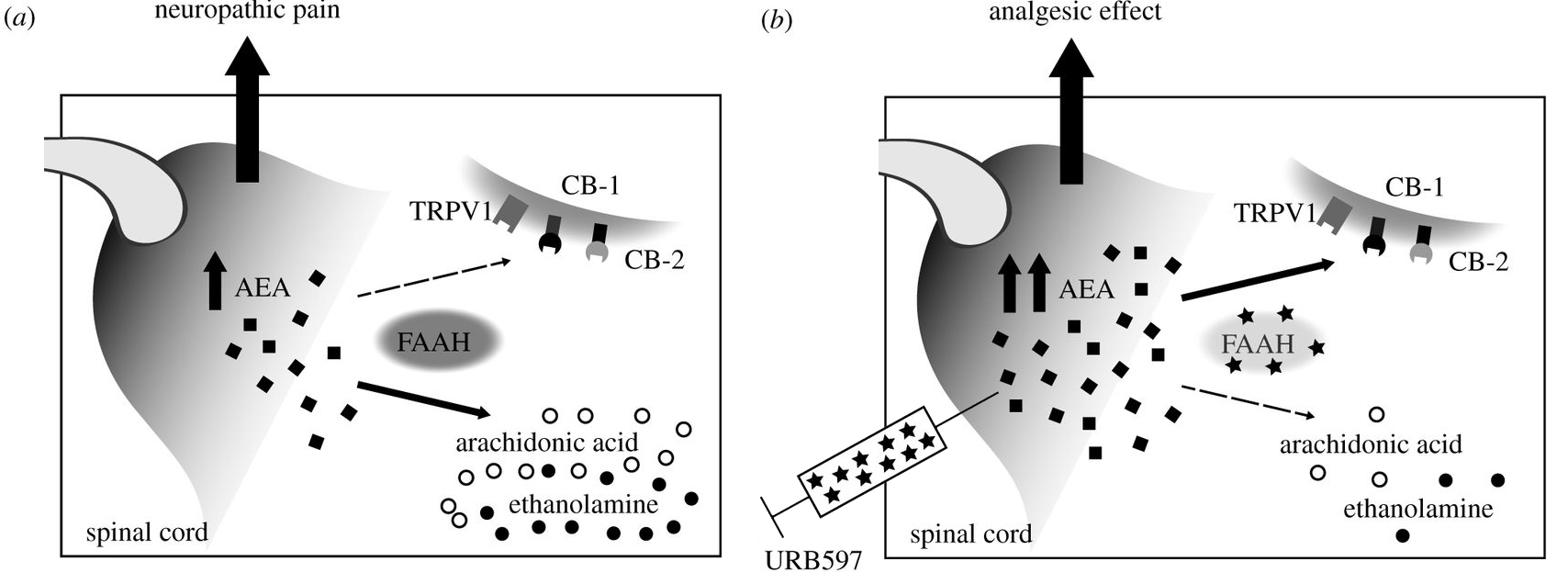
A hírek szerint magyar alapanyagból, Olaszországban készített BIA 10-2474 ugyanis egy olyan enzim (FAAH) lehetséges gátlószere, amely az agyban jelen levő endokannabinoidok lebontását végzi. Ez azért lényeges, mert az endokannabinoidok nagyon fontos modulátorai az idegműködésnek, és számos élettani folyamatot pl. a memória, hangulat, fájdalom- és éhségérzet szabályozásában szerepet játszik. Ezekhez kapcsolódott volna egyébként a Bial kutatása is: reményeik szerint egy új fájdalomcsillapítót fejlesztettek volna.
Mivel az endokannabinoid rendszer működését itthon is számos csoport vizsgálja, megkerestem Aliczki Manót, aki az Akadémia Kísérleti Orvostudományi Kutatóintézetében (MTA KOKI) dolgozik, hogy pontosabban írja körül, mi is lehetett a gyógyszerfejlesztés célja, és hol mehetett félre a dolog. Magyarázata szerint az FAAH specifikusan az egyik endokannabinoidunkat, az anandamidot bontja. Ha gátoljuk az enzimet, egyrészt nem bontja le az anandamidot, másrészt annak visszavétele is gátlódik, így az felhalmozódik a szinaptikus résben, tehát gyakorlatilag fokozható vele az endokannabinoid aktivitás. Mivel anandamidot csak ott állítanak elő neuronok és emiatt az ott is hat, ahol épp „szükség van rá”, a lebontásának gátlásával csak ott erősítjük fel az endokannabinoid aktivitást, ahol az amúgy is éppen jelen van, nem pedig bekapcsoljuk az összes receptort az agyban (mint ahogy azt a cannabis aktív komponense a THC teszi). A megközelítés viszonylagos szelektivitása miatt a gyógyászatban is elkerülhetőek egyes mellékhatások (amelyek pl. a receptorok általános bekapcsolásával jelentkeznének), nem véletlenül komoly trend ez a módszer a kutatásban és komoly perspektíva a klinikumban is.
Hogy mi lehett most a gond, nehéz egyelőre megmondani, csak találgathatunk. A FAAH rengeteg más dolgot is bont az anandamidon kívül és nehéz megállapítani, hogy egy adott hatás melyik vegyület bontásának a következménye. A BIA 10-2474 esetében az enzim kis mértékű szelektivitása miatt olyan folyamatokat is manipulálhatott a kezelés, ami előre nem látható komoly mellékhatásokhoz vezetett. De persze az sem zárható ki, hogy maga a gyógyszer-jelölt nem megfelelően szelektív, azaz mást is befolyásolhatott a kezelés a FAAH-on kívül, ami megint csak mellékhatásokhoz vezethetett. A kis szelektivitasra van példa az endokannabinoid rendszert célzó kezelések között, így példul az endokannabinoid transzportot (és feltehetőleg az anandamid bontást is) gátló AM404 molekula (ami a paracetamol egyik bioaktív származéka is) a vanilloid 1-es receptorok (TRPV1) gyenge agonistája, így nemcsak az anandamid szintet növelheti egy vele való kezelés, de aktiválhatja ezeket a receptorokat is; a FAAH gátló URB597 több tanulmány szerint enyhe gátló hatást fejt ki egy MAGL nevű enzimre is, így az anandamid mellett a másik endokannabinoid, a 2-AG szintjét is növelheti. Sőt, bővebb információ hiányában egyelőre azt sem lehet kizárni, hogy a tragikus következmény egy elrontott adagolás eredménye, vagy esetleg nem is a BIA 10-2474 a hunyó, hanem az ún. vivőanyag, amibe keverve a szervezetbe juttatták.
Utóbbiak ellenére azért fontos leszögezni, hogy nem lenne példátlan, hogy katasztrofális következményekkel jár egy endokannabinoid rendszert befolyásoló gyógyszer. A 2000-es évek elején a rimonabant (SR141716) nevű CB1 receptor antagonistát (amit amúgy kiterjeden használnak preklinikumban) elkezdték étvágycsökkentőként forgalmazni Acomplia néven. Elég sikeresen hozta a fő hatását a klinikai fázisban, azonban mindössze pár év után, 2008-ban, minden piacról visszahívták, mert komoly depresszív mellékhatásokat okozott. Elég nagy botrány volt belőle, nagyott bukott vele a Sanofi.
Jelenleg három vizsgálat is fut a cégnél, azt eldöntendő, hogy mi történt, kinek a hibája a dolog, már ha valakié, egyáltalán. Egy ilyen gyógyszerkísérletnél ugyanis az is benne van a pakliban, hogy a hatást nem lehetett megjósolni előre, ezért is fontosak a megfelelő állatkísérletek, amivel sok veszélyes reagnest már a fejlesztés korai szakaszaiban ki lehet szűrni. Az mindenesetre nyitott kérdés, hogy a hat alany egyszerre kapta-e a kezelést - a TGN1412 ügy egyik fontos tanulsága ugyanis az volt, hogy minimalizálandó a tragédiát, bizonyos időeltéréssel kell a kezeléseket kezdeni, hogy ha valakinél már jelentkeznek a mellékhatások, a többiek még menthetők legyenek (mivel a kiszivárgó információk szerint különböző súlyú komplikációk léptek fel a hat egyénben, lehet, hogy ezt a javaslatot betartották). Mivel első fázisú vizsgálatról van szó, vagyis még nem hatásosságot, hanem pusztán a szer biztonságosságát vizsgálták, egyesek szerint az is szokatlan, hogy viszonylag nagy volt a kontroll csoport: 38-an kaptak placebot.
De legalább ennyire fontos lenne, már a gyógyszerfejlesztés koraibb fázisaiban, ha rendelkezésünkre állna minden információ a hasonló szerkezetű vegyületekkel végzett egyéb vizsgálatokról. Márpedig, mint arra elég hangsúlyosan utal Ben Goldacre, ezzel a látszólag triviális dologgal jelenleg hadilábon állunk.
A nálunk elsősorban a „Rossz tudomány” szerzőjeként ismert brit orvos az utóbbi években tulajdonképpen az egyik legenergikusabb proponense lett az AllTrials kezdeményezésnek, aminek az a lényege, hogy minden valaha, valahol elvégzett gyógyszervizsgálat eredményét (legyen az pozitív, vagy negatív) egy nyilvános adatbázisban kelljen elhelyezni, hogy ne lehessen csak tetszőlegesen kiválasztott adatokkal megtámogatni gyógyszerek piacradobását (hogy ez mennyire nem ritka dolog, arról szól Goldacre "Bad Pharma" című könyve).
Nem tudjuk most még megmondani, hogy a Biotrial kísérlet esetében ez számított volna-e, mindenestre a TGN1412-nél, mint utólag kiderült, léteztek olyan, nem publikált eredmények, egy szerkezetileg hasonló másik szerről, amelyek alapján sejteni lehetett a veszélyeket.
Mindez persze aligha lesz vigasztaló annak az öt, még életben maradt kísérleti alanynak, akik pár hete egészségesen bevonultak az intézetbe egy rutinnak tűnő méréshez (a tapasztalatok alapján az első fázisú kísérletek igazán durva komplikációi nagyon ritkák), a könnyű pénzhezjutás reményében, most pedig a végleges és végletes agykárosodás rémével kell szembenézzenek.
[A poszt eredetileg a ScienceMeetup blogjában jelent meg.]







