 A genetikai kód univerzalitása, vagyis az a tény, hogy a legkülönfélébb organizmusokban, azonos DNS bázis-tripletek azonos aminosavakat kódolnak, az élet közös eredetének, a valamikor régen élt, mitikus Közös Ős létének az egyik legerősebb bizonyítéka. Hiszen tényleg elképzelhetetlenül elenyésző annak az esélye, hogy egymástól függetlenül, többször is pont ugyanaz a degenerált kódtábla alakuljon ki, ahol egy-egy aminosavat, illetve a fehérjelánc végét jelző STOP kodont szervezetenként átlagosan három, különböző bázishármas kódolhat.
A genetikai kód univerzalitása, vagyis az a tény, hogy a legkülönfélébb organizmusokban, azonos DNS bázis-tripletek azonos aminosavakat kódolnak, az élet közös eredetének, a valamikor régen élt, mitikus Közös Ős létének az egyik legerősebb bizonyítéka. Hiszen tényleg elképzelhetetlenül elenyésző annak az esélye, hogy egymástól függetlenül, többször is pont ugyanaz a degenerált kódtábla alakuljon ki, ahol egy-egy aminosavat, illetve a fehérjelánc végét jelző STOP kodont szervezetenként átlagosan három, különböző bázishármas kódolhat.
Épp ezért a kód közel univerzalitása ma már nem képezi vita tárgyát, és a közel jelző is csak arra vonatkozik, hogy bizonyos, speciális körülmények között, főleg kis genomú, parazita vagy patogén élőlények (jellegzetesen baktériumok), illetve sejtorganellumok (lásd mitokondrium) képesek arra, hogy például a három létező STOP kodon (UAA, UAG, UGA) közül az egyiket egy aminosav kódolására is használják. (Erre azért van lehetőség, mert a három STOP kodont a fehérjeszintézis során két különböző fehérje, ún. release faktor (RF1 és RF2) ismeri fel és ha az egyik működésképtelen lesz, akkor vagy a UAG, vagy a UGA triplet "jelentés nélküli" lesz - a UAA-t mindkét RF felismeri.)
Ez adta azonban az ötletet sokaknak, hogy kipróbálják, mi történik, ha az egyik STOP kodon jelentését megváltoztatjuk, és olyan aminosavat kezdünk vele kódoltatni, ami természetesen nem fordulhatna elő az adott baktériumban (egyelőre praktikusan Escherichia coli-t használtak a kutatók, hiszen ennek a genomjáról tudunk a legtöbbet.)
A kísérlet-sorozat egyik főszereplője az a George Church, akit alig pár hete, a mamut-klónozás apropóján emlegettem, és akinek a MAGE nevű, a baktériumok genomjának gyors megváltoztatására alkalmas technológiája már több éve a rendelkezésünkre áll (anno Church neandervölgyis elszólása apropóján már írtam is róla).
A MAGE segítségével egy teljes E. coli genomot Church laborjában újrakódoltak, és az UAG-t szabaddát tették, így csak azt kellett eldönteni, milyen nem-standard aminosavat vigyenek be. Mivel egy ilyen Genetikailag Újrakódolt Organizmus (GRO) alapvetőleg GMO is, természetesen az egyik dolog, amivel óvatosnak kell lenni, hogy ne tudjon elszabadulni, praktikusan képtelen legyen a laboron kívül életben maradni. Hogy ezt elérjék Chruch-ék, illetve velük párhuzamosan egy másik csoport, arra feküdt rá, hogy esszenciális fehérjéket úgy változtassanak meg, hogy azok csak nem-standard aminosavak (NSAA) jelenlétében legyenek működőképesek.
A két megközelítés közül talán a Church-csoporté tekinthető a heroikusabbnak, hiszen több tucat fehérje kristályszerkezetét nyalták végig olyan szerkezeteket keresve, ahol a nem-standard aminosav egy szoros pozícióban lenne. Mivel munkájukban nem-standard aminosavként a különösen nagyméretű L-4,4'-biphenylalanin (bipA) nevű vegyületet használták, a vele interakcióban levő aminosavakat olyanokra kellet cserélni, amelyek kisebbek, így a fehérje szerkezete összességében nem változhatott (ráadásul a két mutáció miatt az is nehezebbé válik, hogy olyan mutációk alakuljanak ki, amelyek révén a baktérium függetleníti magát a bipA-tól). Végül három, a genom különböző részeiben levő enzim mellett döntöttek, mert kísérleteik azt mutatták, hogy ezen mutációk együttes jelenléte teljes mértékben függővé tette a GRO-t a bipA-tól, így nem tud "elszabadulni" a környezetben - legalább is közel egy trilliónyi sejtből egy sem volt képes erre. (Természetesen, mellesleg egy arabinózzal indukálható rendszert is bevittek, ami a bipA-t a riboszómához szállító, UAG-t felismerő tRNS-t tartalmazott, illetve a bipA és a tRNS összekötését végző enzimet is.)
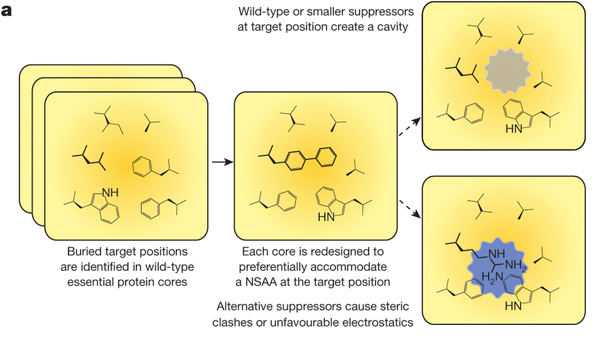 A Church-ékkel párhuzamosan dolgozó Farren Isaacs csoportja ennél szelídebb megközelítéssel vágott bele a dologba: egyszerűen esszenciális fehérjékben egy-egy aminosavat kicseréltek p-azido-phenylalaninra (pAzF) - ez egy másik NSAA - és megnézték funkcionális marad-e így a fehérje. Ha igen, akkor több ilyen mutációt kigyűjtve, azokat a már emlegetett MAGE technológiával egyszerre vittek be egy bakteriális genomba. Ilyenkor, a pAzF hiányában a fehérjeszintézis elakadt és jó eséllyel működésképtelen termék alakult ki.
A Church-ékkel párhuzamosan dolgozó Farren Isaacs csoportja ennél szelídebb megközelítéssel vágott bele a dologba: egyszerűen esszenciális fehérjékben egy-egy aminosavat kicseréltek p-azido-phenylalaninra (pAzF) - ez egy másik NSAA - és megnézték funkcionális marad-e így a fehérje. Ha igen, akkor több ilyen mutációt kigyűjtve, azokat a már emlegetett MAGE technológiával egyszerre vittek be egy bakteriális genomba. Ilyenkor, a pAzF hiányában a fehérjeszintézis elakadt és jó eséllyel működésképtelen termék alakult ki.
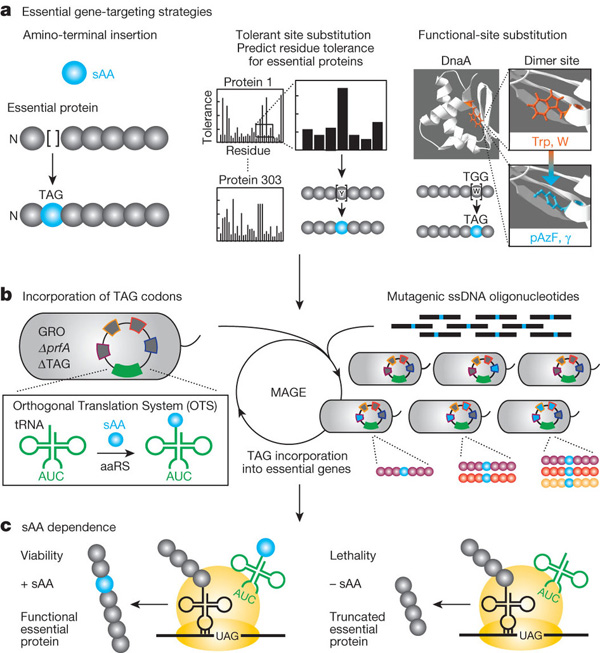
Isaacs-ék szintén arra jutottak, hogy három mutáció szimultán jelenléte szükséges ahhoz, hogy ne alakuljanak ki "menekítő mutációk" még hosszú idő alatt sem (vagyis a szabadban pAzF nélkül életképtelen legyen az újrakódolt. E. coli).
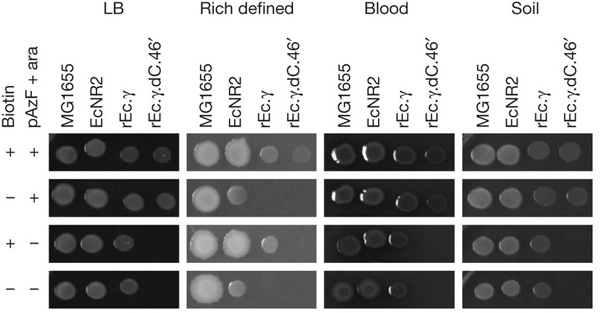
Na de mire jó mindez, a technológiai újdonságon túl? Azon túl, hogy más génmódosítással párosítva biztonságosabb GMO-kat eredményezhet, megnyitja a kaput további kodon-átkódolások előtt, amelyek révén nem egy, hanem több NSAA is bevihető majd a baktériumokba - és ezek révén olyan fehérjetulajdonságok is létrehozhatók, amelyek a standard aminosavszettel nem érhetők el. Mindenesetre Chruch-ék már most 7 további kodon "felszabadításán" munkálkodnak.
(Az első grafika a Frontlinedesk cikkéből van.)
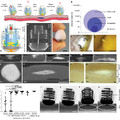
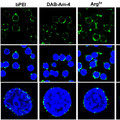
Rovner AJ, Haimovich AD, Katz SR, Li Z, Grome MW, et al. (2015) Recoded organisms engineered to depend on synthetic amino acids. Nature doi: 10.1038/nature14095.
Mandell DJ, Lajoie MJ, Mee MT, Takeuchi R, Kuznetsov G, et all. (2015) Biocontainment of genetically modified organisms by synthetic protein design. Nature doi: 10.1038/nature14121.