 A mai történet annyira kacskaringós, amennyire csak lehetséges, bár a biológiában egyáltalán nem szokatlan, hogy valami érdekeset kezdesz vizsgálni ami a végén egy teljesen más, ám nem kevésbé érdekes eredményre vezet. Annak idején, még 1999 -ben Blond és munkatársai közölték le, hogy egy azonosítottak egy retrovírust, aminek meglepő módon több példánya is megtalálható az emberi genomban. Ezeket HERV -nek nevezték el, azaz emberi endogén retrovírusnak.
A mai történet annyira kacskaringós, amennyire csak lehetséges, bár a biológiában egyáltalán nem szokatlan, hogy valami érdekeset kezdesz vizsgálni ami a végén egy teljesen más, ám nem kevésbé érdekes eredményre vezet. Annak idején, még 1999 -ben Blond és munkatársai közölték le, hogy egy azonosítottak egy retrovírust, aminek meglepő módon több példánya is megtalálható az emberi genomban. Ezeket HERV -nek nevezték el, azaz emberi endogén retrovírusnak.
Elsőként megvizsgálták, hogy ezek a genomban föllelhető retrovírus genomok kifejeződnek -e egyáltalán, vagy teljesen működésképtelenné váltak már. Meglepő módon a vírus génjeiről átíródó RNS nyomait megtalálták emberi méhlepényben, azonban szívben, agyban, tüdőben, májban, vázizomban, vesében és hasnyálmirigyben nem. Ekkor még nem állt rendelkezésükre az emberi genom teljes bázissorrendje, úgyhogy egy cDNS könyvtárat vizsgáltak végig, aminek eredményeként megállapították, hogy a HERV vírus pol génje mellett az emberi méhlepényben RNS másolat készül a szomszédos gag és env génekről is, ezek közül azonban csak az env gén terméke kódolt működőképes fehérjét, a gag és a pol inkább pszeudogéneknek tűntek. A helyzetet bonyolította, hogy az akkor rendelkezésre álló adatok alapján is ez a vírus genom több példányban található meg az emberi genomban és az egyes példányokban a különböző gének egészen más mutációkat hordoztak, így nagyon nehezen tudtak bármi átfogó következtetést levonni erről a genomunkba épült retrovírusról, feltételezték, hogy valami szerepe is lehet, mivel a méhlepényben fejeződik ki, nyilván a terhesség során. Végül HERV-W -nek nevezték el ezt az egész endogén retrovírus családot.
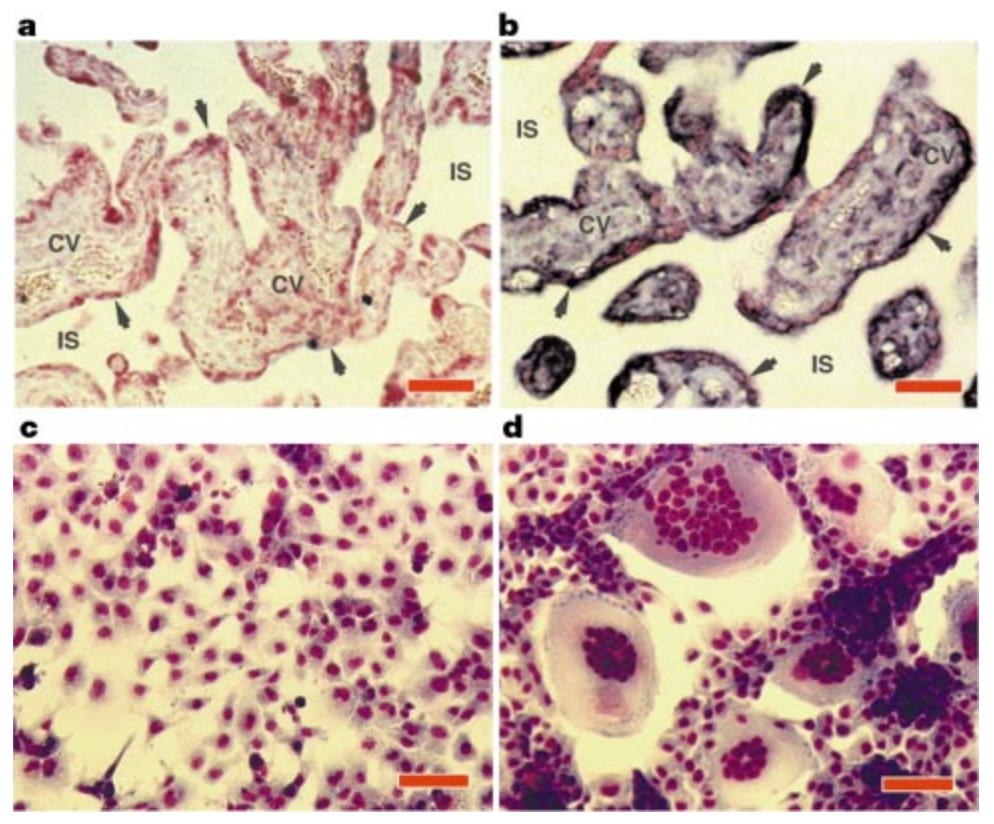
Egy évvel később Mi és munkatársai közölték le, hogy ők egy egészen más módszerrel azonosították ugyanezt a gént, amit syncyctinnek neveztek el, ami a HERV-W endogén retrovírus env génje, ami a vírus egyik envelope-fehérjéjét kódolta eredetileg. Megállapították, hogy ez az endogén retrovírus legalább egy példányben megtalálható a negyedik, hatodik, hetedik, tizenhatodik, tizenhetedik, huszonegyedik, huszonkettedik és az X kromoszómán is, ám vélhetőleg a hetedik kromoszómán található HERV-W elem tartalmazza a kifejeződő syncyctin gént. Az előző szerzőkhöz hasonlóan ők is azt tapasztalták, hogy a syncyctin gén kizárólag méhlepényben és herében fejeződik ki. In situ RNS hibridizálással azt is kimutatták, hol fejeződik ki, meglepő módon egyedül a sokmagvú szinciciális trofoblasztokban. (Ez látható az első ábrán, az "a" kép a negatív kontroll, a "b" az RNS hibridizálás, a fekete nyilak mutatják a szinciciális trofoblaszokat.) Ezek után egy emberi sejtvonalban (COS) kifejeztették a syncyctin gént, meglepő módon az eredetileg egymagvú COS sejtek a Syncyctin fehérje hatására sokmagvú, szincíciális képletekké álltak össze, ebből megállapították, hogy a Syncyctin fehérje valószínűleg a sejtek szincíciummá olvadásában játszik szerepet. (Ez látható az első ábrán, "c" a kontroll, "d" a Syncyctint kifejező COS sejtek.) Meglepő módon egy csomó más sejtvonal sejtjei is képesek voltak összeolvadni a Syncyctint kifejező COS sejtekkel, emberi HeLa, kínai aranyhörcsög eredetű CHO, sőt, lepke eredetű Sf9 sejtek is bekapcsolódtak a COS szincíciumokba. Itt már nagyon úgy tűnt, hogy a syncyctin egy retrovírus eredetű gén, ami az emberi genomba kerülve hasznos működést végez.
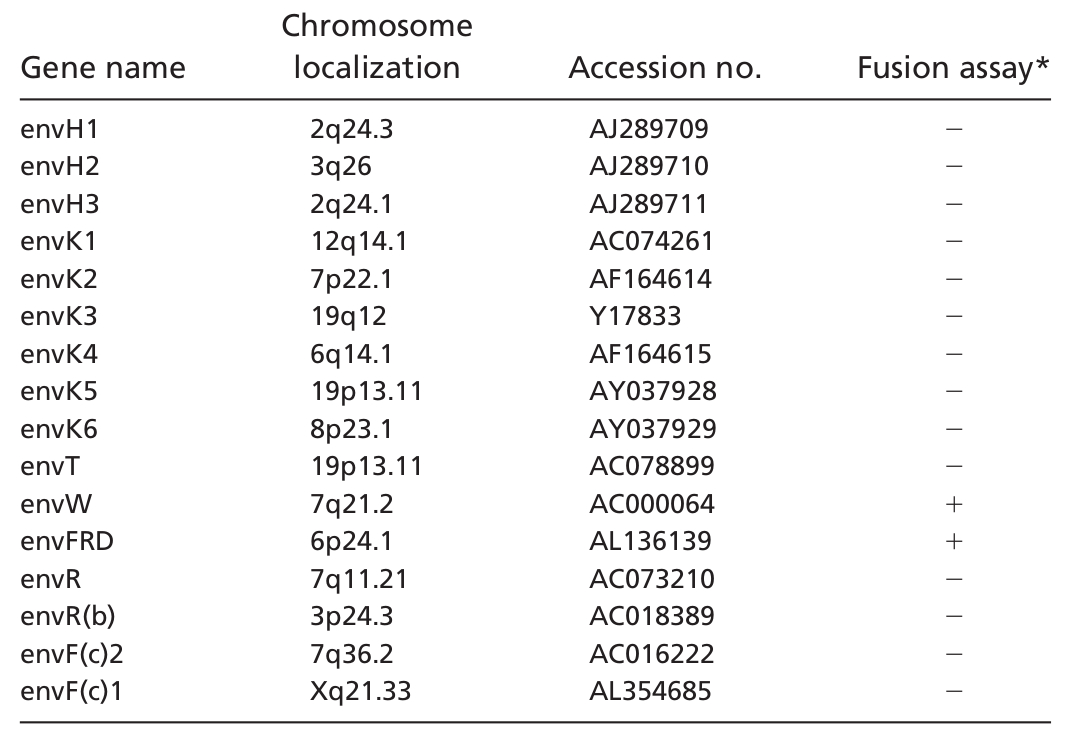
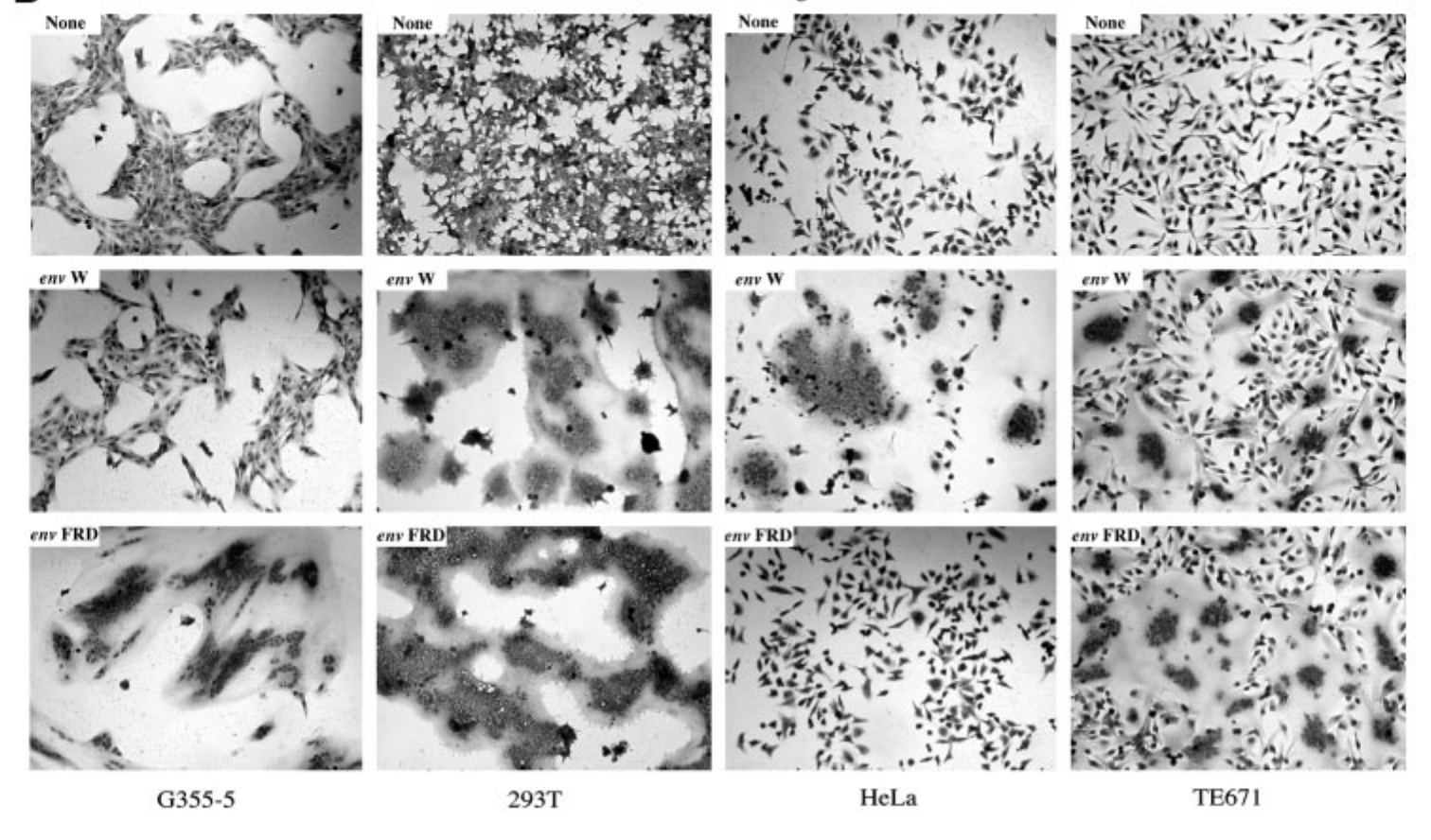
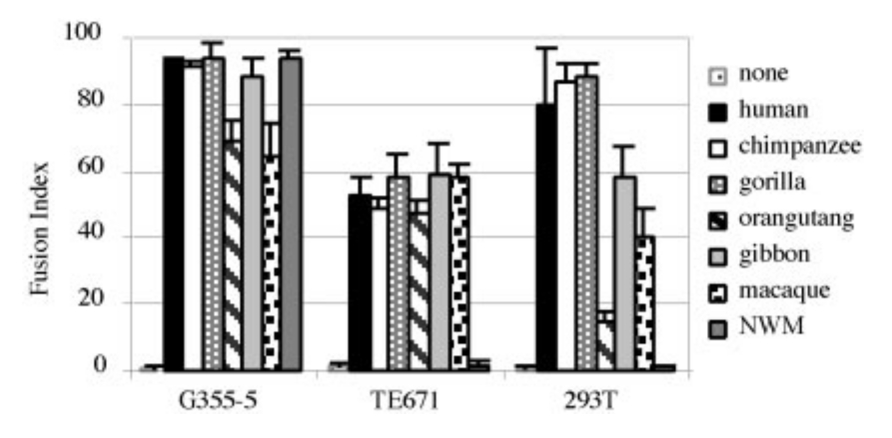
Blaise és munkatársai 2003 -ban érdekes adalékot szolgáltattak ehhez a történethez. Ők már az emberi genom 95% -nak ismeretében kezdhettek dolgozni, így egyszerűen nyilvános adatbázisokból kikeresték a genomban található HERV elemeket. Összesen tizenhat különböző ép fehérjét kódoló env gént találtak a genomban szétszórva, ezt mutatja a a második ábra. Mindegyiket több különböző sejtvonalban is kifejeztették, majd megvizsgálták, hogy a sejtek szincíciumokat alakítanak -e ki. Meglepő módon a tizenhat génből csak kettő kódolt olyan fehérjét, amely képes volt szincíciumokká ragasztani a sejteket (fuzogén aktivitás), az egyik a már ismert EnvW, a másik egy másik HERV család envelop fehérjéje az EnvFRD, a többi tizennégy nem mutatott ilyen működést. Ez látható a harmadik ábrán, a sorokban látható a kontroll az egyik illetve a másik fehérje hatása, oszlopokban pedig a vizsgált sejtvonalak. Az újonnan felfedezett syncyctin gén kizárólag méhlepényben fejeződik ki, nem túl meglepő módon. Ami viszont érdekes, hogy a HERV-FRD retrovírus egy diploid genomban körülbelül száz példányban található meg, ám nem csak az emberi genomban, de a csimpánz, gorilla, orángután, gibbon, makákó, kapucinusmajom genomokban is, ahogy ezt a negyedik ábra mutatja. A gén konzerváltsága meglepő, az ember és a kapucinusmajom envFRD génje 88% -ban azonos, pedig az utolsó közös ősünk olyan negyvenmillió éve élt, ez arra utal, hogy valamilyen fontos működést végez. Kipróbálták, ezek a fehérjék szincíciumokká ragasztják -e a sejteket, ennek az eredménye látható a negyedik ábrán, igen a majmok EnvFRD fehérjéi is fuzogén aktivitásúak.
Mangeney és munkatársai 2007 -ben egészen más oldalról közelítették meg a kérdést. Miután azt tapasztalták, hogy a retrovírusok envelop fehérjéi csökkenthetik a gazda immunválaszát, megvizsgálták, hogy az emberi Syncyctin fehérjéknek van -e ilyen hatása. Egy egértörzsbe oltották az MCA205 daganat sejtvonal sejtjeit, amelyek az egerekben nem okoztak daganatot, mert az immunrendszerük elpusztította a bekerült idegen sejteket. Ellenben ha a sejtek egy retrovírus Env fehérjéjét fejezik ki, az csökkenti az immunválaszt, a beoltott sejtek nagy, maradandó daganatokat képeznek az egerekben. Meglepő módon azt tapasztalták, hogy a Syncyctin-1 fehérje nem csökkenti az immunválaszt, míg a Syncyctin-2 fehérje erős immunszuppreszív hatású. Úgy tűnik, a Syncyctin-1 fehérje elvesztette ezt a hatását, azonban elkészítették a Syncyctin-1 egy mutáns változatát, amely két pontmutációban különbözött a vad típusútól (R14Q, F20A), amely visszanyerte az immunszuppresszív hatását úgy, hogy mellette megtartotta a fuzogén aktivitását is.
A szaporítószervek evolúciója mindig izgalmas kérdés, hiszen könnyen belátható, hogy ha egy élőlénynek nem születnek utódai, akkor számára az evolúció véget ért. Az emlősök szaporodásának kulcsfontosságú szerve a méhlepény, amelynek a szöveti elrendeződése egészen szokatlan az emlős testben, ám nagyon jól szolgálja a magzat védelmét a szülői immunrendszer támadásaitól. Nyilván adódik a kérdés, hogyan alakulhat ki egy ilyen szerv lépésenként? A méhlepény kialakulásának molekuláris elemzése nyomán viszont meglepően egyszerű a válasz: A sokmagvú szincíciumot kialakító és a magzatot az immunrendszer támadásaitól védő fehérjék nem a többsejtűekben alakultak ki, a már régóta létező gerincesek genomjába egyszerűen horizontális génátvitellel kerültek át egy retrovírusból, ahol az eredetileg a vírus szaporodását szolgáló rendszer, egy teljesen új szerv, a méhlepény kialakításához járultak hozzá.
Blond J., Beséme F., Duret L., Bouton O., Bedin F., Perron H., Mandrand B., Mallet F., (1999): Molecular Characterization and Placental Expression of HERV-W, a New Human Endogenous Retrovirus Family. JOURNAL OF VIROLOGY 73:1175–1185
Mi S., Lee X., Li X., Veldman G. M., Finnerty H., Racie L., LaVallie E., Tang X., Edouard P., Howes S., Keith Jr J. C., McCoy J. M. (2000): Syncytin is a captive retroviral envelope protein involved in human placentalmorphogenesis. Nature 403:785-789
Blaise S., Parseval N., Bénit L., Heidmann T. (2003): Genomewide screening for fusogenic human endogenous retrovirus envelopes identifies syncytin 2, a gene conserved on primate evolution. PNAS 100(22): 13013–13018
Mangeney M., Renard M., Schlecht-Louf G., Bouallaga I., Heidmann O., Letzelter C.,
Richaud A., Ducos B., Heidmann T. (2007): Placental syncytins: Genetic disjunction between the fusogenic and immunosuppressive activity of retroviral envelope proteins. PNAS 104(51): 20534–20539