Az Európai Tanács 2006-ban fogalmazta meg a 1924/2006/EK rendeletét, mely - többek között - kimondja, hogy az élelmiszereknek és táplálékkiegészítőknek is a gyógyszerekhez hasonló bizonyítási procedúrán kell átesniük, ha valamilyen feltételezett pozitív egészségügyi hatással bírnak.
„(13) Az egyes tagállamokban az élelmiszerek címkézésekor és reklámozása során számos olyan, jelenleg is alkalmazott állítás használatos, amelyek olyan anyagokkal kapcsolatosak, amelyek kedvező volta nem igazolt, vagy amelyeket illetően pillanatnyilag nincsen kellő tudományos egyetértés. Biztosítani kell, hogy az anyag, amelyre az állítás vonatkozik, valóban rendelkezzen kedvező táplálkozási vagy élettani hatással.”
„(22) Az egészségre vonatkozó állítások használatát csak a lehető legmagasabb színvonalú tudományos értékelést követően lehet engedélyezni a Közösségben. Ezen állítások összehangolt tudományos értékelése érdekében az Európai Élelmiszer-biztonsági Hatóságnak kell elvégeznie ezeket az értékeléseket.”
E rendeletre hivatkozva utasított el az Eu rópai Élelmiszer-biztonsági Hatóság (EFSA) 2012. decemberéig mintegy 1500 kérelmet, így ezen termékek csomagolásán nem tüntethető fel többé a probiotikus jelző (224 termék kapott rá engedélyt). Vagyis mostantól az EU-ban bizonyítani is kell, hogy egy adott termék olyan élő mikrobákat tartalmaz, amelyek kedvező hatással vannak az azt megfelelő mennyiségben fogyasztó egészségére, nem lehet csak úgy ráírni egy pohár joghurtra vagy egy kapszulás üvegre, hogy ha ezt isszuk-esszük, megedződik az immunrendszerünk, nem leszünk többé asztmások, rendbe jön a bélflóránk, esetleg elmúlik a depressziónk.
rópai Élelmiszer-biztonsági Hatóság (EFSA) 2012. decemberéig mintegy 1500 kérelmet, így ezen termékek csomagolásán nem tüntethető fel többé a probiotikus jelző (224 termék kapott rá engedélyt). Vagyis mostantól az EU-ban bizonyítani is kell, hogy egy adott termék olyan élő mikrobákat tartalmaz, amelyek kedvező hatással vannak az azt megfelelő mennyiségben fogyasztó egészségére, nem lehet csak úgy ráírni egy pohár joghurtra vagy egy kapszulás üvegre, hogy ha ezt isszuk-esszük, megedződik az immunrendszerünk, nem leszünk többé asztmások, rendbe jön a bélflóránk, esetleg elmúlik a depressziónk.
Na de mi a baj a probiotikumokkal? És vajon miért szentel a Nature Biotechnology idei 4. száma jó néhány összefoglaló, elemző cikket a probiotikumok és a humán bélflóra témájának?
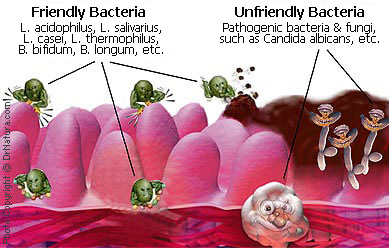
A probiotikomok története több, mint száz évre nyúlik vissza. 1907-ben a bolgár joghurtfogyasztási „népsport” jótékony hatásait kutatva írta le azt Mecsnyikov, a Pasteur intézet Nobel-díjas kutatója, hogy mivel a bélbaktériumok mennyisége és minősége függ a megevett ételtől, ezért elképzelhető, hogy a „káros” bélflórát lecseréljük „jóra”. Tissier, egy francia gyermekorvos ezidőtájt (1906) tapasztalta, hogy hasmenéses gyermekek székletében kevesebb Y alakú (bifid, azaz kettéágazó) baktérium észlelhető, mint egészséges társaikéban. Azt javasolta, hogy ezeket a bifiobaktériumokat kéne a hasmenéses gyermekeknek adni, hogy helyreálljon a normál bélflórájuk. Megfigyelésük után nem sokkal később piacra került pár bakteriális készítmény, melyek nagy része sajnos nem váltotta be a hozzájuk fűzött reményeket. Így a probiotikus koncepciót sokáig tudományosan nem bizonyítottnak vélték, és évtizedeken keresztül kevés figyelmet (és persze apanázst) kaptak az ezirányú kutatások [1]. Az elmúlt harminc évben viszont megtört a jég, és elözönlötték a boltok polcait a probiotikus joghurtitalok, kapszulák (őrület, az USA-ban még probiotikus víz, illetve szénsavas üdítő is kapható).
Hogy megértsük, hogyan is hatnak a szervezetre az élő baktériumokat tartalmazó készítmények, tisztában kell lennünk a normál emberi bélflóra összetételével. Az amerikai állam illetve az EU által támogatott US Human Microbiome Project és a MetaHit (European Metagenomics of the Human Intestinal Tract) célja az emberi bélflóra felderítése. Egészséges emberek emésztőtraktusában található baktériumok génjeit szekvenálták/szekvenálják meg székletmintákból izolált DNS-ből (maga a megszekvenált bakteriális gének könyvtára a mikrobiom) és hasonlítják azokat össze a különféle emésztőszervi megbetegedésekben szenvedőkével.
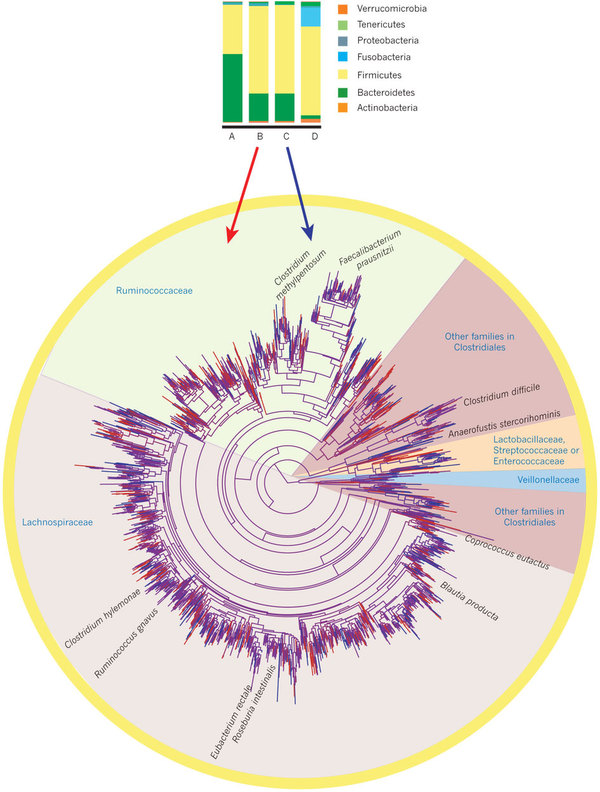
A múlt évszázadban használt, tenyésztésen alapuló baktérium meghatározás alapján a legtöbb felnőtt ember bélflórája hasonlónak bizonyult, például E.coli-t minden ember székletéből ki lehet tenyészteni. Azonban a fenti két projektben is használt, tenyésztés nélküli szekvenálás teljesen más képet mutat. A normál humán bélflóra nagy része anaerob (vagyis légköri oxigéntől mentes környezetben élő) vagy mikroaerofil (alacsony oxigén-szintet szerető) baktérium, amelyeket nem triviális normál laborkörülmények között tenyészteni. E projektek eddigi eredményei alapján egy átlagos emberi széklet minden egyes grammja kb százmilliárd baktériumot tartalmaz. Ebből kiindulva durván százszor annyi baktérium él bennünk, mint ahány saját sejtünk van. Egy átlagos felnőtt emésztőrendszerében kb ezer különböző baktériumfaj található, a legtöbb az Bacteroidetes (Bacteroides fajtok) és a Firmicutes (Clostridium, Lactobacillus, Streptococcus és Bacillus fajok) törzsbe sorolhatók. Az Actinobacteria (Mycobacterium, Streptomyces, Ruminococcus, Bifidobacterium fajtok), Protobacteria (Escherichia, Salmonella, Vibrio fajok) valamint a Verrucomicrobia törzsekbe (Methylacidiphilum fajok) tartozó baktériumok csak kevés egyed- illetve fajszámmal vannak jelen a bélben. A baktériumflóra összetétele egyénenként eltérő, és függ még az életkortól, a földrajzi előfordulástól (ennek oka lehet populációgenetikai, vagy visszavezethető eltérő étrendre illetve eltérő környezeti tényezőkre) és egészségügyi állapottól is [2, 3]. Ez utóbbi eredmények nem mondanak sok újat, hiszen az eddig is ismert volt, hogy az újszülöttek kvázi steril bélfalát az anyán és a közvetlen környezetben található baktériumok kezdik el kolonizálni, öröklött és egyéb faktorok befolyásolják, hogy mely baktériumok tudnak megtelepedni, majd az étkezési szokások illetve a különböző betegségek erős szelekciós tényezőkként hatnak rájuk.
Apropó szelekció. Miért is jó az nekünk, hogy több milliárd baktérium inkubátorai vagyunk? Miért nem aktiválódik az immunrendszer, és írtja ki őket? Az újszülöttek immunrendszere még igencsak fejletlen, így a bélrendszert ekkor kolonizáló baktériumok nem váltanak ki válaszreakciót. Az immunrendszer bélben található sejtjei különösen fontos szerepet játszanak abban a folyamatban, ami során az immunrendszer megtanulja megkülönböztetni a kórokozókat a hasznos lakótársaktól, a káros antigéneket a semlegesektől. A túl steril környezet, a különféle antibakteriális szappanok, fertőtlenítők túlzott használata miatt a nyugati kultúrában a gyermekek immunrendszere nem találkozik a fejlődés korai szakaszában annyi antigénnel, mint a kevésbe „tiszta” kultúrákban felnövő gyerekeké, ami a befolyásolhatja az immuntolerancia kialakulását, és okozhatja a különféle populációk között tapasztalható pollen- és ételallergiás megbetegedési adatok közti különbséget [4]. A legtöbb bélbaktérium amúgy inkább élettárs, mint kórokozó, az, hogy a bélfalat benépesítik, nincs a szervezetünkre rossz hatással. Sőt, néhányan képesek olyan vitaminok és aminosavak előállítására, amelyekre a szervezetünknek szüksége van, viszont előállítani nem tudja azokat (pl K-vitamin), valamint számunkra emészthetetlen növényi poliszacharidok és gyógyszerek bontására is képesek. Vagyis nemcsak a mi táplálkozásunk képes befolyásolni a baktériumközösség összetételét, de a baktériumok metabolizmusa is hatással van a miénkre.
Az emberi bélflóra direkt tanulmányozásán kívül humanizált bélflórájú laboratóriumi állatok vizsgálatával is sok hasznos információ birtokába juthatunk. Az egéren kívül a zebrahal is tartható az angol szakzsargon által germ-free-nek nevezett körülmények között, ami alatt teljes mikrobamentességet kell értenünk. A humanizált bélflórájú kísérleti állatok germ-free élőlények, melyek bélrendszerét egy komplett emberi bélbaktérium-közösséggel kolonizálták. Ezen állatok bélflórájának kialakulását a donorok változtatásával, a gazdaszervezet immunrendszeri sajátságainak és a környezeti paraméterek változtatásával kísérletesen lehet befolyásolni, és a kapott hatást tanulmányozni [5].
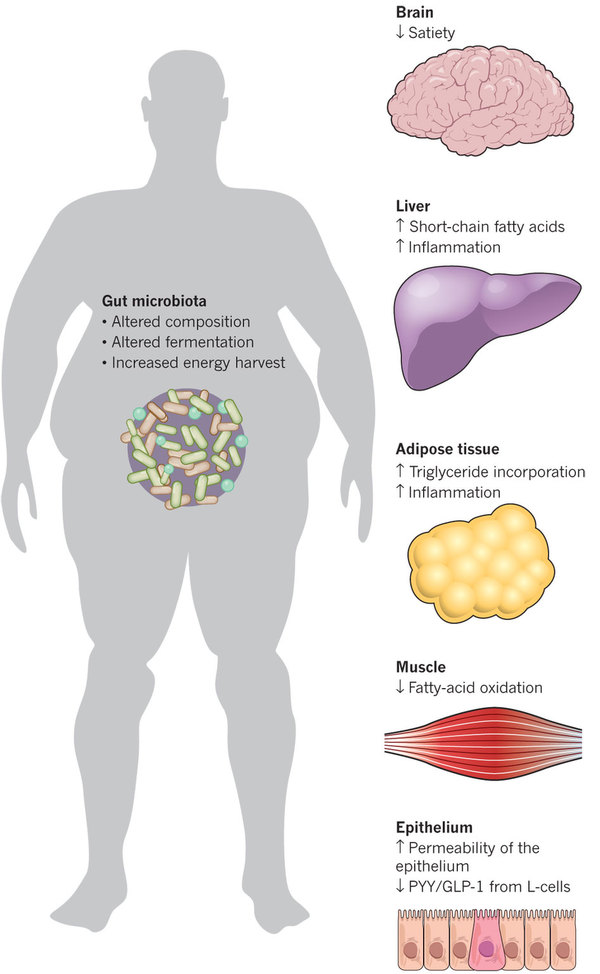 E hihetetlenül gazdag (és mint láttuk, átültethető) mikroökoszisztémák kutatása nem csak azért izgalmas, mert mondjuk a metabolikus szindrómában és inzulin-rezisztenciában szenvedők „rossz” baktériumait le lehet cserélni „jó” mikrobákra vékonybéltartalomtranszferrel [6] (ez a humán fécesztranszplantációs szabadalom már klinikai tesztelés alatt áll), így csökkentve a cukorbetegség kialakulásának kockázatát, hanem mert az adott ember bélflóráját ismerve egyénre szabott étrendi és gyógykezelési döntéseket lehet hozni. Például, hogy érdemes-e prosztatarákra masszívan szóját enni, vagy paracetamol helyett szedjünk inkább ibuprofent. A szójának csontritkulás, prosztatarák, szív- és érrendszeri megbetegedések esetén kimutatták jótékony hatását. Az ezért felelős (S)—equol nevű hatóanyagot a szója egyik izoflavonjából bélbaktériumok állítják elő. Azok a baktériumok, melyek erre képesek, Japán, Kína vagy Kórea felnőtt lakosságának durván kétharmadában fordulnak elő, míg az európai vagy amerikai kontinensen élőknek csak a negyede hordozza őket. Így a rákellenes hatás csak az adott baktériumokat hordozók esetén várható [7]. Szintén bélflórafüggő, hogy a paracetamol acetaminofenszulfáttá vagy acetaminofen-glükuroniddá alakul át. Ha a bélben jelen vannak olyan baktérium kolóniák, amelyek ún p-krezol nevű anyagot termelnek, akkor a paracetamol méregtelenítéséért is felelős, a májban termelődő szulfotranszferáz enzimet ez a termék lefoglalja, így a paracetamol májkárosító hatása felerősödik [8].
E hihetetlenül gazdag (és mint láttuk, átültethető) mikroökoszisztémák kutatása nem csak azért izgalmas, mert mondjuk a metabolikus szindrómában és inzulin-rezisztenciában szenvedők „rossz” baktériumait le lehet cserélni „jó” mikrobákra vékonybéltartalomtranszferrel [6] (ez a humán fécesztranszplantációs szabadalom már klinikai tesztelés alatt áll), így csökkentve a cukorbetegség kialakulásának kockázatát, hanem mert az adott ember bélflóráját ismerve egyénre szabott étrendi és gyógykezelési döntéseket lehet hozni. Például, hogy érdemes-e prosztatarákra masszívan szóját enni, vagy paracetamol helyett szedjünk inkább ibuprofent. A szójának csontritkulás, prosztatarák, szív- és érrendszeri megbetegedések esetén kimutatták jótékony hatását. Az ezért felelős (S)—equol nevű hatóanyagot a szója egyik izoflavonjából bélbaktériumok állítják elő. Azok a baktériumok, melyek erre képesek, Japán, Kína vagy Kórea felnőtt lakosságának durván kétharmadában fordulnak elő, míg az európai vagy amerikai kontinensen élőknek csak a negyede hordozza őket. Így a rákellenes hatás csak az adott baktériumokat hordozók esetén várható [7]. Szintén bélflórafüggő, hogy a paracetamol acetaminofenszulfáttá vagy acetaminofen-glükuroniddá alakul át. Ha a bélben jelen vannak olyan baktérium kolóniák, amelyek ún p-krezol nevű anyagot termelnek, akkor a paracetamol méregtelenítéséért is felelős, a májban termelődő szulfotranszferáz enzimet ez a termék lefoglalja, így a paracetamol májkárosító hatása felerősödik [8].
A normál baktériumflóra mindezeken felül azért is fontos, mert fizikailag beteríti azt a helyet, amit a kórokozók is elfoglalnának. Egy antibiotikum kezelés kiöli a bélbolyhokról a normál baktériumközösség nagy részét, így effektíve szabaddá válik egy hatalmas ökológiai niche, és megindul a harc a helyekért. Hogy végül milyen új bélflóra alakul ki, az sok tényezőtől függ, de nagy eséllyel hasonlít majd az eredetihez, mivel akármilyen tiszta körülmények között is élünk, környezetünk teli van fekális eredetű mikrobákkal, amikben a kezelés előtti saját és családtagjaink baktériumai dominálnak. Ilyen antibiotikumos kezelések után (rosszabb esetben alatt is) kifejezetten ajánlják a gyártók a szuperebbnél is szuperebb összetételű probiotikumaikat - amiket ne keverjünk a tejet joghurttá savanyító Lactobacillus acidophylis-szel vagy L. bulgaricus-szal. A probiotikumok sok csodabacijáról már kiderült (például a Lactobacillus casei, L. plantarum, L. reuteri, L. rhamnosus, L. delbrueckii, Streptococcus thermophiles, Saccharomyces boulardii, a Bifidobacterium animalis esetén), hogy nem tagjai a normál bélflórának, és nem is kolonizálják a bélfalat. Vagyis ha nem rendszeresen fogyasztjuk az adott terméket, ezek a baktériumok élve áthaladnak a bélrendszeren (mondjuk ez is egy nagy kihívás, hogy a gyomor savas közege vagy az epe diszpergáló hatása ne tegye őket tönkre), ott éppenséggel szaporodnak, de nem telepednek le, kiürülnek a szervezetből [9,10]. Ha van is jótékony hatásuk, ezt addig kell kifejteniük, míg a bélrendszeren átutaznak.
Na de mi a helyzet a probiotikumok jótékony hatásával?
Mindenkinek érdeklődőnek szívből ajánlom M. Crislip, fertőző betegségekre specializált amerikai orvos probiotikumos bejegyzését a Science-Based Medicine oldalán, élvezetesen szedi darabjaira egy probiotikus joghurtitalt gyártó cég érveit. Csak pár, általam fontosnak tartott részt emelnék ki a teljesség igénye nélkül. Először is vegyük a tényleges előnyöket. Klinikai tesztek szerint a probiotikumok hatásosnak bizonyultak antibiotikum-okozta hasmenés és irritábilis bél szindróma esetén. De egészséges embereken végzett tesztek egymásnak ellentmondó eredményre vezettek. Crislip állítása szerint egy, a szervezet által ismeretlen baktériumot vagy -keveréket tartalmazó probiotikus ital elfogyasztása egy enyhe ételmérgezésnek fogható fel. A bélben található immunsejtek az emberi evolúció során arra szakosodtak, hogy a bélbaktériumokat ne engedjék át a bélfalon a szervezetbe jutni, illetve az ételben található kórokozókat minél hamarabb eliminálják. A joghurtital elfogyasztása után az emésztés felgyorsul, az immunredszer aktivizálódik. Ezek általános és normális fiziológiás reakciók egy baktériumokkal teli táplálék esetén, így igazak a probiotikumokra is. De hogy ezek a hatások kedvezőek lennének, az már más kérdés. Az immunrenszer különböző elemeinek aktiválására utalva használják a gyártók az immunerősítő jelzőt ezekre a termékekre. Ez egy ügyes marketing-fogás, valójában ez gyulladást jelent. Egy egészséges ember immunrendszerét nem kell erősíteni. Ha valamilyen patogén éri, akkor aktiválódik. Ha egy szervezet egy enyhe fertőzéssel van elfoglalva, és ekkor éri egy nagyobb fertőzés, akkor az immunrendszer hamarabb képes a második fertőzésre reagálni, de ettől még nem a legjobb megoldás Crislip szerint magunkat krónikus enyhe fertőzésben tartatni. Egyrészt ez megnöveli a szív-és érrendszeri betegségek kialakulásának lehetőségét, másrészt a probiotikum-szedés abbahagyása utáni 1-2 hónapban megnő valamilyen egyéb fertőzés kialakulásának esélye. Immunhiányos állapot esetén pedig kifejezetten ellenjavallt a probiotikumok szedése.
Nem csoda, hogy az EU után az amerikai FDA is megfogalmazott egy szabályrendszert, ami alapján a különféle probiotikus termékeket engedélyezteti. A probiotikumok szigorúbb kontrollja és a fécesz- illetve bélflóratranszfer kísérletek sikerei után személy szerint kíváncsian várom a kreatív táplálékkiegészítő-fejlesztők következő termékeit.
Az 1. és 2. ábra forrása: guardian.co.uk és google.nl
1. http://www.who.int/foodsafety/publications/fs_management/en/probiotics.pdf.
2. Qin, J., et al., A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010.
464(7285): p. 59-65.
3. Lozupone, C.A., et al., Diversity, stability and resilience of the human gut microbiota. Nature, 2012.
489(7415): p. 220-30.
4. Willyard, C., Microbiome: Gut reaction. Nature, 2011. 479: p. S5-S7.
5. Gootenberg, D.B. and P.J. Turnbaugh, Companion animals symposium: humanized animal models of the
microbiome. J Anim Sci, 2011. 89(5): p. 1531-7.
6. Vrieze, A., et al., Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals
with metabolic syndrome. Gastroenterology, 2012. 143(4): p. 913-6 e7.
7. Jackson, R.L., J.S. Greiwe, and R.J. Schwen, Emerging evidence of the health benefits of S-equol, an estrogen
receptor beta agonist. Nutr Rev, 2011. 69(8): p. 432-48.
8. Clayton, T.A., et al., Pharmacometabonomic identification of a significant host-microbiome metabolic interaction
affecting human drug metabolism. Proc Natl Acad Sci U S A, 2009. 106(34): p. 14728-33.
9. McNulty, N.P., et al., The impact of a consortium of fermented milk strains on the gut microbiome of gnotobiotic
mice and monozygotic twins. Sci Transl Med, 2011. 3(106): p. 106ra106.
10. Schmidt, C., The sturtup bugs. Nature Biotechnology, 2013. 31(4): p. 279-281.



