Tegnap este többek között az index.hu és az origo.hu is beszámolt arról, hogy Dr. Szabó Marcel, a jövő nemzedékek érdekeinek védelméért felelős ombudsmanhelyettes vizsgálatot indít Magyarországon, hogy kiderüljön, az élelmiszerek hány százaléka készül emberi embrionális sejtek felhasználásával.
Tegnap este többek között az index.hu és az origo.hu is beszámolt arról, hogy Dr. Szabó Marcel, a jövő nemzedékek érdekeinek védelméért felelős ombudsmanhelyettes vizsgálatot indít Magyarországon, hogy kiderüljön, az élelmiszerek hány százaléka készül emberi embrionális sejtek felhasználásával.
„Dr. Szabó Marcel, ombudsmanhelyettes azt mondta, az általa indított vizsgálat elsősorban fogyasztóvédelmi szempontokra támaszkodva a fogyasztói tudatosság erősítésére szolgál, amelynek végeredményeként akár olyan rendszert is el tud képzelni, hogy a termékek címkéjén szerepeljen az embrionális eredetre utaló jelzés.”
Az index cikke annyi logikai bukfencet és szakmai pontatlanságot tartalmaz(ott, azóta többször javították) a republikánus oklahomai kormányzótól származó, amerikai internetes oldalakról átvett összeesküvés-elmélet félreértés mellett, hogy talán megéri részletesebben foglalkozni a témával.
„Dr. Szabó Marcel hétfői sajtótájékoztatóján nem sorolt fel konkrét gyártókat és konkrét termékeket, amelyek adalékanyagait embrionális sejtek felhasználásával tesztelik, de az amerikai sajtóból az utóbbi hónapokban tudható, hogy elsősorban a kaliforniai Senomyx vállalat partnercégeiről lehet szó. Ez a biotechnológiai vállalat a HEK293 sejtvonalba emberi ízérzékelő receptorok génjeit kódolja, majd a szóba jöhető ízfokozó molekulákat teszteli ezeken a receptorokon. Amelyek között a legerősebb a kölcsönhatás, arról feltételezik, hogy legjobban fokozza az emberi ízlelést. A technológia az ombudsman szerint komoly etikai kérdéseket vet fel, mivel emberi embriókból (konkrétan egy holland nő abortált magzatából) eredeztethető ... A Senomyx-szal olyan gigavállalatokat hoztak hírbe az amerikai sajtóban, mint az üdítőgyártó Pepsi, az édességeket forgalmazó Nestlé, Cadbury Adams vagy például a Milka csokikat, Philadelphia sajtot forgalmazó Kraft Foods. Közülük a Pepsi és a Nestlé be is ismerte az együttműködést, azonban arra vonatkozóan semmilyen bizonyíték sincs, hogy ezek a népszerű termékeket gyártó gigacégek milyen természetű kapcsolatban állnak a Senomyx-szal. Illetve hogy az együttműködésük kiterjed-e arra, hogy csokoládéikban, üdítőikben alkalmazzák-e a HEK293-at.”
Mielőtt (stílusosan) átrágnánk magunkat a különféle célokra fenntartott sejttenyészetek típusain, azok jellemzőin és felhasználhatóságán, szeretném még az elején leszögezni, hogy annak a valószínűsége, hogy bármilyen élelmiszeripari termékben emberi eredetű sejtvonalat, pláne humán embrió eredetű sejtet találjunk, körülbelül nulla. Nonszensz az embriómentes élelmiszer kategória, mivel nincs embriós élelmiszer. Annyira releváns egy ilyen vizsgálat, mint például azt vizsgálni, hogy a magyar borok hány százaléka tartalmaz borkóstolót. Egy félig informált laikus gondolhatja azt, hogy a teszteléskor használt anyagot használják aztán az élelmiszerek gyártására is (a kóstoláskor kiköpött bort visszarakják a palackba) - egyébként nem, nem használják újra, minden sejtkultúrával kapcsolatba került anyag veszélyes hulladéknak minősül; de ott már nagy logikai gubanc van, ha valaki a tesztelőt rakatja bele az ételbe (a borkóstolót az üvegbe). Humán sejtvonalakat nem használnak élelmiszergyártásra. Legfeljebb az a kérdés lehet értelmes ebben a szituációban, hogy etikus-e az, hogy az adott élelmiszer adalékanyagainak vagy hozzávalóinak tesztelésekor illetve azok kiválasztásakor humán embrionális eredetű sejtvonalat használtak.
Az állati sejttenyésztés története az 1900-as évek elejére nyú lik vissza. A kutatók célja az volt, hogy az élőlényeket felépítő különféle szövetek és szervek működését, normál és kóros élettani folyamatait szemmel követhessék mikroszkóp alatt. Mivel az eredeti szervek, szövetek több tízezer sejtből állnak, sokszor több centiméter vastagok, nem igazán lehet azokat mikroszkóppal megfigyelni, és az adott élőlényből kivéve csak ideig-óráig életképesek. A baktériumok táptalajon való tenyésztését alapul véve adódott az ötlet, hogy egy adott szövet sejtjeit különválasztva, tápanyagokkal ellátva fenntartsák. Mivel azonban a baktériumok számára az állati eredetű sejtek igencsak könnyen hasznosítható táptalajnak bizonyultak, az antibiotikumok széleskörű felhasználásáig a sejttenyésztés nem igazán számított a rutin kísérletek közé. Az 1940 és 1950 közötti gyermekbénulási járvány alatt azonban nagy lett a nyomás a polio vírus ellenszerének kikísérletezésére és ipari méretű előállítására. 1948-ben sikerült a vírust emberi sejteken tenyészteni (amit embrionális agyból nyertek [1]), majd pár évre rá a legyengített kórokozóból oltóanyagot előállítani. Ekkor vált nagyüzemivé az állati és emberi sejtek tenyésztése. Az 1970-es években a rekombináns DNS technikák fejlődésével egyre több emberi fehérjét próbáltak meg baktériumokban (főként terápiás célokra) előállítani. Az inzulint ugyan sikerült a bakteriális expressziós rendszerből működőképes állapotban kinyerni, sok eukarióta fehérje térszerkezete azonban nem alakul ki megfelelően a bakteriális sejtekben, illetve a fehérjékre a szintézis után nem kerül rá a szükséges poliszaccharid oldallánc, így a bonyolultabb fehérjék előállítását állati illetve emberi sejtvonalakban kellett megoldani. A következő nagy mérföldkő a sejttenyésztés történetében a hibridóma sejtek előállítása volt, amelyek képesek egy bizonyos típusú ellenanyag folyamatos termelésre. Ez is hihetetlen nagyüzem, terápiás, diagnosztikai és egyéb kísérletes felhasználást ellátó, több millió dolláros iparág a monoklonáris ellenanyag termelés.
lik vissza. A kutatók célja az volt, hogy az élőlényeket felépítő különféle szövetek és szervek működését, normál és kóros élettani folyamatait szemmel követhessék mikroszkóp alatt. Mivel az eredeti szervek, szövetek több tízezer sejtből állnak, sokszor több centiméter vastagok, nem igazán lehet azokat mikroszkóppal megfigyelni, és az adott élőlényből kivéve csak ideig-óráig életképesek. A baktériumok táptalajon való tenyésztését alapul véve adódott az ötlet, hogy egy adott szövet sejtjeit különválasztva, tápanyagokkal ellátva fenntartsák. Mivel azonban a baktériumok számára az állati eredetű sejtek igencsak könnyen hasznosítható táptalajnak bizonyultak, az antibiotikumok széleskörű felhasználásáig a sejttenyésztés nem igazán számított a rutin kísérletek közé. Az 1940 és 1950 közötti gyermekbénulási járvány alatt azonban nagy lett a nyomás a polio vírus ellenszerének kikísérletezésére és ipari méretű előállítására. 1948-ben sikerült a vírust emberi sejteken tenyészteni (amit embrionális agyból nyertek [1]), majd pár évre rá a legyengített kórokozóból oltóanyagot előállítani. Ekkor vált nagyüzemivé az állati és emberi sejtek tenyésztése. Az 1970-es években a rekombináns DNS technikák fejlődésével egyre több emberi fehérjét próbáltak meg baktériumokban (főként terápiás célokra) előállítani. Az inzulint ugyan sikerült a bakteriális expressziós rendszerből működőképes állapotban kinyerni, sok eukarióta fehérje térszerkezete azonban nem alakul ki megfelelően a bakteriális sejtekben, illetve a fehérjékre a szintézis után nem kerül rá a szükséges poliszaccharid oldallánc, így a bonyolultabb fehérjék előállítását állati illetve emberi sejtvonalakban kellett megoldani. A következő nagy mérföldkő a sejttenyésztés történetében a hibridóma sejtek előállítása volt, amelyek képesek egy bizonyos típusú ellenanyag folyamatos termelésre. Ez is hihetetlen nagyüzem, terápiás, diagnosztikai és egyéb kísérletes felhasználást ellátó, több millió dolláros iparág a monoklonáris ellenanyag termelés.
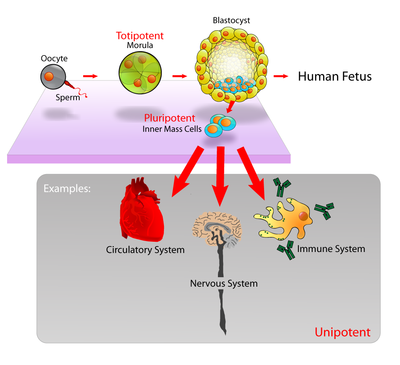 És akkor most jutottunk el az utóbbi évek nagy szenzációjához, az őssejtekhez, amelyek széleskörű terápiás felhasználásához (az előzetes állatkísérletek alapján) nagy remények fűződnek, néhány betegséget pedig már évek óta sikeresen kezelnek őssejt-terápiával. Az embrionális őssejteket a be nem ültetett mesterségesen megtermékenyített kb. százsejtes blasztociszta állapotú embrióból nyerik. Ezek a sejtek eleve képesek arra, hogy számtalanszor osztódjanak (míg egy kifejlődött szöveti sejt csak 50 osztódásra képes), így sejtkultúraként petri-csészében fenntarthatók, és ezek az embrionális őssejt-vonalak kísérletes és terápiás célokra felhasználhatók. A fejlettebb embrióból (például abortált magzatból) vagy egy már kifejlődött szervezetből kivett szövetből először ún. primer sejtkultúra készül, amelynek sejtjei egy bizonyos számú sejtosztódás után „kiöregednek” és elpusztulnak, vagy valamilyen oknál fogva immortalizálódnak, és így passzálható sejtvonallá válnak. A rákos sejtek nagy többsége képes még erre a trükkre, nem is csoda, hogy a sejtvonalak nagy része valamilyen rákos sejt leszármazottja.
És akkor most jutottunk el az utóbbi évek nagy szenzációjához, az őssejtekhez, amelyek széleskörű terápiás felhasználásához (az előzetes állatkísérletek alapján) nagy remények fűződnek, néhány betegséget pedig már évek óta sikeresen kezelnek őssejt-terápiával. Az embrionális őssejteket a be nem ültetett mesterségesen megtermékenyített kb. százsejtes blasztociszta állapotú embrióból nyerik. Ezek a sejtek eleve képesek arra, hogy számtalanszor osztódjanak (míg egy kifejlődött szöveti sejt csak 50 osztódásra képes), így sejtkultúraként petri-csészében fenntarthatók, és ezek az embrionális őssejt-vonalak kísérletes és terápiás célokra felhasználhatók. A fejlettebb embrióból (például abortált magzatból) vagy egy már kifejlődött szervezetből kivett szövetből először ún. primer sejtkultúra készül, amelynek sejtjei egy bizonyos számú sejtosztódás után „kiöregednek” és elpusztulnak, vagy valamilyen oknál fogva immortalizálódnak, és így passzálható sejtvonallá válnak. A rákos sejtek nagy többsége képes még erre a trükkre, nem is csoda, hogy a sejtvonalak nagy része valamilyen rákos sejt leszármazottja.
Az immortalizált sejtvonalak tipikusan egyfajta sejtből állnak, melyek morfológiája eltér az eredeti primer kultúrában található sejtekétől. A kísérletek során használt sejtvonalak eredete mindig pontosan ismert, hiszen legtöbbször ez a szempont játszik szerepet az adott sejtvonal kiválasztásában. A már említett rekombináns fehérje előállításon, ellenanyag- és oltóanyag-gyártáson túl ipari méretekben különféle hatóanyagok tesztelésére használják az immortalizált sejteket. A gyógyszer-jelöltek, potenciális ízfokozók, új kozmetikai szerek hatóanyagait első körben sejtkultúrához adják, és az arra gyakorolt pozitív vagy negatív hatás alapján szelektálnak a jelöltek közül. Amelyik anyag a sejtek nagy részét megöli vagy sejt-szinten nem váltja ki a várt hatást, azzal felesleges állatkísérleteket, majd pedig például gyógyszerek esetén páciensekkel történő klinikai kutatást folytatni. Ez, lássuk be, nem csak gazdaságilag, de etikailag is releváns.
A Cell Line Database nyilvántartásában 6636 különféle sejtvonal szerepel, ebből 4915 valamilyen emberi szövetből származik. Ebből az alábbi 20 embrionális eredetű:
- HFFF2 - Human Caucasian fetal foreskin fibroblast - előbőr eredetű fibroblaszt
- WRL 68 - Human embryonic liver - máj
- HEPM - Human embryonic palatal mesenchyme – szájpadlás erdetű mezenchima
- Detroit 551 és WS1 Human embryonic skin – bőr
- RH, 293 – human embryonic kidney – vese
- S1814.PB5 Human embryonic fibroblast – fibroblaszt
- C16, FLOW2002, HEL 12469, HF 19, HFL1, IMR-90, L132, MRC5, MRC7, MRC9, WI26, WI38 – human embryonic lung – tüdő eredetű fibroblaszt
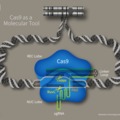
A HEK293 sejtvonal 5-ös adenovírussal transzformált humán embrionális vese eredetű sejteket tartalmaz [2], melyek érdekes módon idegsejtekre jellemző fehérjéket expresszálnak, például szagló-, szerotonin- GABA-, illetve dopamin-receptorokat (lásd 2. táblázatot). Mindezek alapján valószínűsíthető, hogy az adenovírus az embrionális vesében jelen levő valamilyen idegsejteket fertőzött meg, ezek immortalizálódtak, így aztán a vese eredetű primer kultúra végül egy idegsejt-szerű sejtvonallá alakult át [3].
Ez a neuronokhoz hasonló fehérje-expressziós mintázattal rendelkező sejtvonal kitűnő alanya az idegrendszert érintő vizsgálatoknak. Nemcsak olcsóbb, de egyszerűbb is egy ilyen sejtvonalat használni. A tesztelés automatizálható, egyszerre egy edényben akár 96 molekulát le lehet tesztelni. Képzeljük magunk elé azt a helyzetet, amikor egy patkányt próbálunk kikérdezni arról, hogy a 18-as minta édesebb vagy keserűbb ízélményt nyújtott neki az imént, mint a 29-es. Nem csoda tehát, hogy ezt sejtvonalat használta a fenn említett cég a tesztelésére. A sejtvonal eredendően egy humán embrió veséjéből készült, de 1977 óta csak flaskából flaskába, illetve az inkubátorból a fagyasztóba vagy éppen a mikroszkóp alá vándorol. Fenntartásához nincs szükség további humán embriókra.
Etikátlan lenne-e a használata bármilyen kísérlethez? Kutatóként és magánemberként úgy vélem, nem. Etikátlanabb lenne állati vagy humán agyszeletekkel kísérletezni, ha a rendelkezésünkre áll egy ilyen sejtvonal. Ahogy etikátlan alaptalanul fölösleges pánikot kelteni fogyasztóvédőként és/vagy újságíróként azt a látszatot keltve, hogy léteznek embrió-szöveteket tartalmazó élelmiszerek.
Ábrák forrása: palomar.edu, colepalmer.com, http://hu.wikipedia.org
1. Enders, J.F., T.H. Weller, and F.C. Robbins, Cultivation of the Lansing Strain of Poliomyelitis Virus in Cultures of Various Human Embryonic Tissues. Science, 1949. 109(2822): p. 85-7.
2. Graham, F.L., et al., Characteristics of a human cell line transformed by DNA from human adenovirus type 5. J Gen Virol, 1977. 36(1): p. 59-74.
3. Shaw, G., et al., Preferential transformation of human neuronal cells by human adenoviruses and the origin of HEK 293 cells. Faseb J, 2002. 16(8): p. 869-71.