 Ha már a különböző logika szerint működő immunrendszerekről beszélünk, mindenképpen érdemes megemlíteni az állkapocs nélküli gerincesek immunrendszerét. Ebbe a csoportba a nyálkahalak és az ingolák tartoznak, ezek a jószágok nem túlzottan ismertek, pedig például ingolával itt Magyarországon is találkozhatunk. Az immunrendszerük megdöbbentő módon hasonló logika szerint működik, mint az emlősöké, de teljesen különböző elemekből áll. No de lássuk csak, mik is ezek az eltérések!
Ha már a különböző logika szerint működő immunrendszerekről beszélünk, mindenképpen érdemes megemlíteni az állkapocs nélküli gerincesek immunrendszerét. Ebbe a csoportba a nyálkahalak és az ingolák tartoznak, ezek a jószágok nem túlzottan ismertek, pedig például ingolával itt Magyarországon is találkozhatunk. Az immunrendszerük megdöbbentő módon hasonló logika szerint működik, mint az emlősöké, de teljesen különböző elemekből áll. No de lássuk csak, mik is ezek az eltérések!
 Ha már a különböző logika szerint működő immunrendszerekről beszélünk, mindenképpen érdemes megemlíteni az állkapocs nélküli gerincesek immunrendszerét. Ebbe a csoportba a nyálkahalak és az ingolák tartoznak, ezek a jószágok nem túlzottan ismertek, pedig például ingolával itt Magyarországon is találkozhatunk. Az immunrendszerük megdöbbentő módon hasonló logika szerint működik, mint az emlősöké, de teljesen különböző elemekből áll. No de lássuk csak, mik is ezek az eltérések!
Ha már a különböző logika szerint működő immunrendszerekről beszélünk, mindenképpen érdemes megemlíteni az állkapocs nélküli gerincesek immunrendszerét. Ebbe a csoportba a nyálkahalak és az ingolák tartoznak, ezek a jószágok nem túlzottan ismertek, pedig például ingolával itt Magyarországon is találkozhatunk. Az immunrendszerük megdöbbentő módon hasonló logika szerint működik, mint az emlősöké, de teljesen különböző elemekből áll. No de lássuk csak, mik is ezek az eltérések!
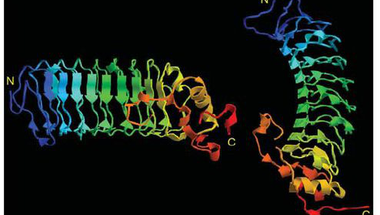
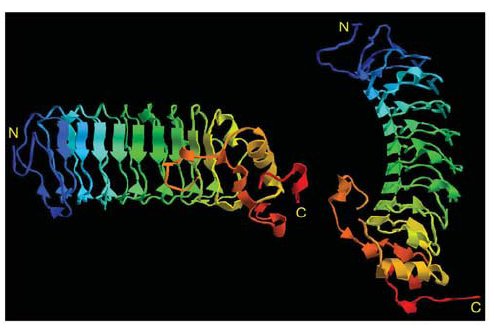
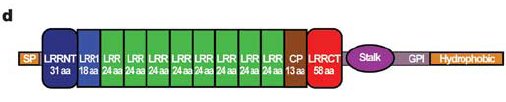
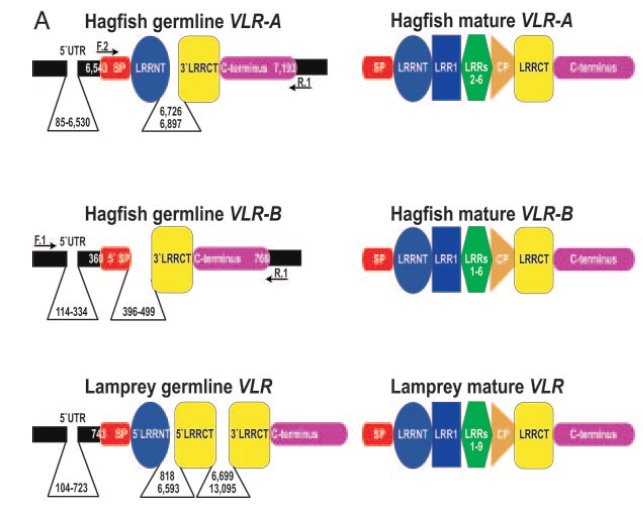
Az már viszonylag régóta ismert, hogy az ingolák antigénspecifikus immunválaszt képesek adni. Ha ugyanis például birka vörösvértesteket adtak a Lampetra reissneri véréhez, akkor gyengén agglutinálta (összecsapta) azokat. Ha azonban a birkavérrel néhány héten át többször beoltották a jószágot ez az agglutináló képessége drámai módon megnőtt, hasonlóan ahhoz, ahogy egy emlős immunizálható. <1> Mivel a többi gerinceshez hasonló immunválaszt adnak, sokáig nem különösebben vizsgálták őket, ám a kétezres években egymás után jelentek meg a közlemények, amelyek fényt derítettek arra, hogy bizony alapvetően másképpen működik az immunrendszerük, mint a miénk. Az első komoly felfedezést Zeev Pancer és munkatársai közölték 2004 -ben. A Petromyzon marinus evű jószág limfocita-szerű sejtjeiből készült expressziós génkönyvtárat vizsgálták meg és azt a meglepő felfedezést tették hogy semmilyen immunglobulin gént sem fejeznek ki ezek a sejtek. Úgy okoskodtak, hogy ha ezek immunfunkciót látnak el, akkor ki kell hogy fejezzék az effektorfehérjéket, így bukkantak rá egy géncsoportra, amit VLR -nek neveztek el (Variable Lymphocyte Receptor). Az immunizált állatok vérsejtjei ugyanis leucinban gazdag repeateket (LRR) tartalmazó fehérjéket kódoló géneket fejeztek ki. A meglepő ebben az volt, hogy az expressziós génkönyvtárukban 1500 megszekvenált mintából 239 ilyen LRR repeateket tartalmazó cDNS -t találtak, ezek közül azonban nem volt kettő azonos, mind a többitől különböző fehérjét kódolt, bár ezen fehérjék doménszerkezete hasonlított egymásra: Az N-terminális szakaszukon egy szignál peptid (SP) és egy mindegyikben hasonló szekvenciájú LRR domén (LRRNT) található, majd változó számú variábilis LRR domének, egy kapcsoló peptid (CP) és újra egy minden klónban hasonló LRR domén (LRRCT), majd egy GPI kötőhely és egy hidrofób farokrégió.
 Ha viszont egyes limfocitákat vizsgáltak meg, azt találták, hogy egy limfocita egyetlen VLR gént fejez ki, tehát a rendszer logikája azonos az emlős immunrendszerével, egy sejt egy receptort fejez ki, de mivel egy állatban keringésében egyszerre sok sejt található, az immunrendszer egyszerre nagyon sok különböző VLR receptort fejez ki. A genom vizsgálatakor azt tapasztalták, hogy a testi sejtekben a VLR fehérjét kódoló gén csak a szignál peptidet, az LRRNT domént, az LRRCT domént a molekula C terminális régióját kódoló szakaszokat tartalmazza, vagyis azokat a régiókat, amelyek minden VLR molekulában hasonlóak, a variábilis LRR domének hiányoznak belőle. Ezekből az adatokból egyértelmű a következtetés, hogy itt is valamilyen génátrendeződés történik az immunsejtekben, ami a nagyszámú különböző VLR molekulát kódoló gént eredményez.
Ha viszont egyes limfocitákat vizsgáltak meg, azt találták, hogy egy limfocita egyetlen VLR gént fejez ki, tehát a rendszer logikája azonos az emlős immunrendszerével, egy sejt egy receptort fejez ki, de mivel egy állatban keringésében egyszerre sok sejt található, az immunrendszer egyszerre nagyon sok különböző VLR receptort fejez ki. A genom vizsgálatakor azt tapasztalták, hogy a testi sejtekben a VLR fehérjét kódoló gén csak a szignál peptidet, az LRRNT domént, az LRRCT domént a molekula C terminális régióját kódoló szakaszokat tartalmazza, vagyis azokat a régiókat, amelyek minden VLR molekulában hasonlóak, a variábilis LRR domének hiányoznak belőle. Ezekből az adatokból egyértelmű a következtetés, hogy itt is valamilyen génátrendeződés történik az immunsejtekben, ami a nagyszámú különböző VLR molekulát kódoló gént eredményez.
Egy évvel később <3> ugyanez a munkacsoport egy Epatetreus burgeri nevű nyálkahal cDNS könyvtárát vizsgálva arra jutottak, hogy tulajdonképpen két VLR receptort kódoló gén található a genomban, ezeket VLR-A és VLR-B -nek nevezték el. (Később kiderült, hogy az ingolák genomjában is egy VLR-A és egy VLR-B gén található, ez értelemszerűen nem szerepel ezen az ábrán.) Azt találták, hogy a genomban a VLR génektől 20-70 kilobázisnyi távolságban különböző LRR doméneket kódoló génszegmentek találhatóak, ezek kerülnek valamilyen rekombinációs események nyomán a molekula N és C terminális konstans régióit kódoló szakaszok közé, így alakítva ki az érett VLR géneket. Érdemes megjegyezni, hogy ekkor még egyetlen teljes genom sem volt ismert ebből a csoportból, így mindkét közleményben cDNS könyvtárakra, vagy a genomi DNSből készített BAC klónokra kellett hagyatkozniuk.
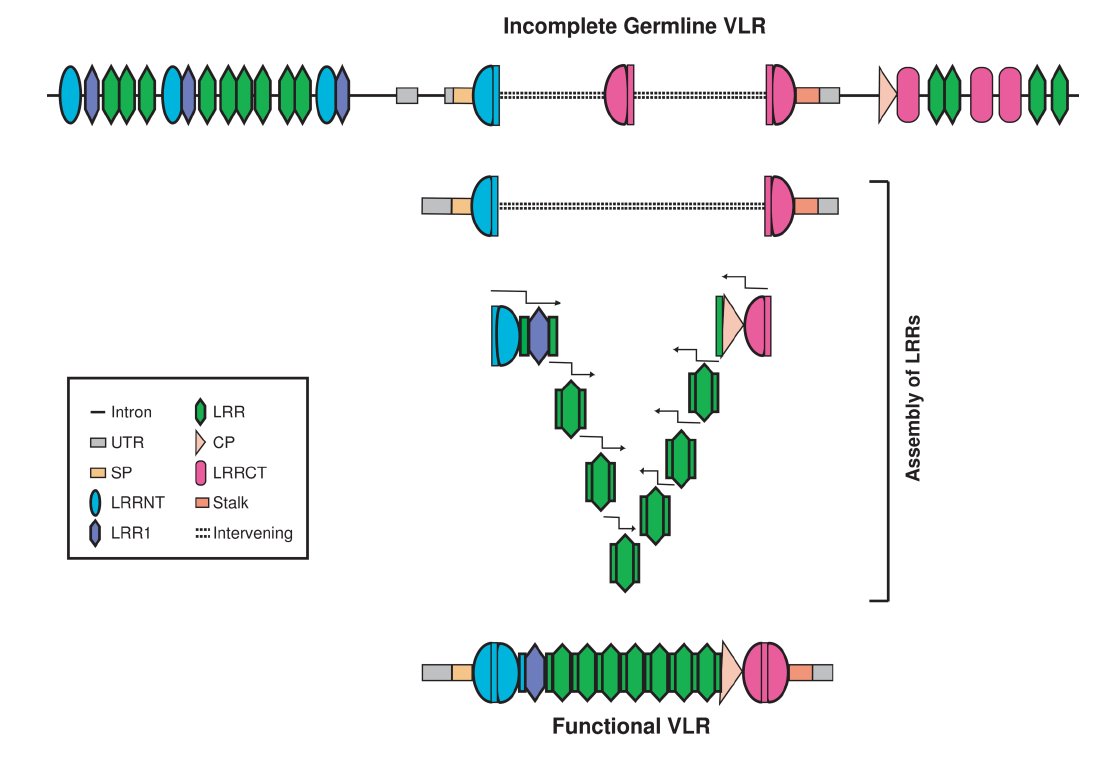
 Egy év múlva, 2006 -ban egy munkacsoport a VLR gének átrendeződésének módjáról jelentetett meg egy közleményt. <4> Ők egy Lethenteron japonicum nevű ingolával dolgoztak, elég egyszerűen közelítették meg a kérdést, 191 különböző átrendezett VLR gént izoláltak, majd megkeresték a genomban azokat az LRR doméneked kódoló génszegmenteket, amikből az átrendezett gének összeálltak. Az egyes LRR génszegmentek körül semmilyen szignálszekvenciát sem találtak, ez eltér az emlős genomtól, ahol a V, D, J, génszegmenteket RSS szekvenciák határolják, viszont az egyes LRR génszegmentek 5' és 3' végein 10-30 bázispárnyi homológiát találtak, azaz az egyik LRR génszegment utolsó néhány bázisa azonos az utána következő LRR génszegment első néhány bázisával. Ez látható az ábrán, a középső sor az átrendezett VLR gén szekvenciája, alatta és fölötte pedig az egyik illetve a másik LRR szegment és genomi környezete látható. Amikor alaposabban megnézték ezeket az átrendezett géneket, azt találták, hogy a géntárendeződésben nem mindig egy teljes LRR domén vesz részt, néha csak egy szakasza kerül be az átrendezett génbe, ilyenkor egy trunkált LRR domén került az érett VLR génbe. Ugyanígy találtak olyan géneket is, amelyek két különböző genomi LRR génszegmentből létrejött hibrid LRR domént tartalmaztak. Ez úgy lehetséges, hogy ezek az LRR génszegmentek nagyon hasonlóak egymáshoz, nem csak az 5' és a 3' végükön, így a génszegment felénél is akadhat eléggé hasonló szekvencia, ami már elég a génátrendeződéshez.
Egy év múlva, 2006 -ban egy munkacsoport a VLR gének átrendeződésének módjáról jelentetett meg egy közleményt. <4> Ők egy Lethenteron japonicum nevű ingolával dolgoztak, elég egyszerűen közelítették meg a kérdést, 191 különböző átrendezett VLR gént izoláltak, majd megkeresték a genomban azokat az LRR doméneked kódoló génszegmenteket, amikből az átrendezett gének összeálltak. Az egyes LRR génszegmentek körül semmilyen szignálszekvenciát sem találtak, ez eltér az emlős genomtól, ahol a V, D, J, génszegmenteket RSS szekvenciák határolják, viszont az egyes LRR génszegmentek 5' és 3' végein 10-30 bázispárnyi homológiát találtak, azaz az egyik LRR génszegment utolsó néhány bázisa azonos az utána következő LRR génszegment első néhány bázisával. Ez látható az ábrán, a középső sor az átrendezett VLR gén szekvenciája, alatta és fölötte pedig az egyik illetve a másik LRR szegment és genomi környezete látható. Amikor alaposabban megnézték ezeket az átrendezett géneket, azt találták, hogy a géntárendeződésben nem mindig egy teljes LRR domén vesz részt, néha csak egy szakasza kerül be az átrendezett génbe, ilyenkor egy trunkált LRR domén került az érett VLR génbe. Ugyanígy találtak olyan géneket is, amelyek két különböző genomi LRR génszegmentből létrejött hibrid LRR domént tartalmaztak. Ez úgy lehetséges, hogy ezek az LRR génszegmentek nagyon hasonlóak egymáshoz, nem csak az 5' és a 3' végükön, így a génszegment felénél is akadhat eléggé hasonló szekvencia, ami már elég a génátrendeződéshez. 
Valamivel később mutatták ki <5>, hogy a VLR-A és VLR-B fehérjék nem azonos működésűek. Mindkét gén szomatikus rekombinációs eseményeken esik át, ám a VLR-B receptort hordozó sejtek képesek csak mikróbákat kötni, a szekretált VLR-B fehérje az immunrendszer effektormolekulája. A VLR-A sejtek feltételezhetően valamilyen szabályozószerepet töltenek be az immunrendszer működésekor.
Ha kicsit elmélyedünk review cikkekben is, <1> meglepő adatokat találhatunk. Például, hogy a zebradánió és a gömbhal, vagyis csontoshalak genomjában megtalálható két, a VLR-A és VLR-B fehérjékhez hasonló fehérjét kódoló gén, bár ezek nem esnek át szomatikus rekombináción. Ismert róluk, hogy a vérképző szövetekben kifejeződnek, de a működésükről nincs adatunk. Hogy ezek milyen kapcsolatban állnak az állkapocs nélküli gerincesek VLR molekuláival, azt legfeljebb találgatni lehet.
 Összefoglalva, az állkapocs nélküli gerincesek egy olyan élőlénycsoport, amely rengeteg ősi jelleget őrzött meg. Az immunrendszerük működése még nem ismert olyan részletesen, mint például az emlősöké, ám amit eddig megfejtettek belőle, meglepő módon az emlős immunrendszeréhez hasonló logikára épülő, klonális szomatikus rekombinációval génszegmentekből kialakuló receptorokon és effektormolekulákon alapul. Ezek a molekulák különböznek az emlős immunglobulinoktól, a génátrendeződés módja is különbözik az emlősök RAG1/RAG2 katalizálta V(D)J génátrendeződésétől. Hogy ez a rendszer milyen kapcsolatban van az emlős adaptív immunitással, az egyelőre nem teljesen világos (erről reményeim szerint később még írok), de nem lehetetlen, hogy ezen jószágok vizsgálata fényt deríthet az emlős immunrendszer kialakulására is.
Összefoglalva, az állkapocs nélküli gerincesek egy olyan élőlénycsoport, amely rengeteg ősi jelleget őrzött meg. Az immunrendszerük működése még nem ismert olyan részletesen, mint például az emlősöké, ám amit eddig megfejtettek belőle, meglepő módon az emlős immunrendszeréhez hasonló logikára épülő, klonális szomatikus rekombinációval génszegmentekből kialakuló receptorokon és effektormolekulákon alapul. Ezek a molekulák különböznek az emlős immunglobulinoktól, a génátrendeződés módja is különbözik az emlősök RAG1/RAG2 katalizálta V(D)J génátrendeződésétől. Hogy ez a rendszer milyen kapcsolatban van az emlős adaptív immunitással, az egyelőre nem teljesen világos (erről reményeim szerint később még írok), de nem lehetetlen, hogy ezen jószágok vizsgálata fényt deríthet az emlős immunrendszer kialakulására is.
<1>Saha NR, Smith J, Amemiya CT (2010): Evolution of adaptive immune recognition in jawless vetebrates. Seminars in Immunology 22(1); 25-33
<2>Pancer Z, Amemiya CT, Erhardt GRA, Ceitlin J, Gartland GL, Cooper MD(2004):Somatic diversification of variable lymphocyte receptors in the agnathan sea lamprey. Nature vol. 430 pp174
<3> Pancer Z, Saha NR, Kasamatsu J, Suzuki T, Amemiya CT, Kasahara M, Cooper MD(2005): Variable lymphocyte receptors in hagfish. PNAS vol. 102 no. 26 pp. 9224-29
<4>Nagawa F, Kishishita N, Shimizu K, Hirose S, Miyoshi M, Nezu J, Nishimura T, Nishizumi H, Takahashi Y, Hashimoto S, Takeuchi M, Miyajima A, Takemori T, Otsuka AJ, Sakano H (2006): Antigen-receptor genes of the agnathan lamprey are assembeled by a process involving copy choice. Nature Immunology Vol. 8 no. 2 pp. 206
<5>: Guo P, Hirano M, Herrin BR, Li J, Yu C, Sadlonova A, Cooper MD(2009): Dual nature of adaptive immune system in lampreys. Nature vol. 459 pp. 796