 Úgy tűnik, hogy az EHEC-járvány lecsengőben van, így kicsit megkésve csapnánk e témában a lecsóba. De talán jobb később, mint soha, és a rengeteg egészségügyi témájú cikk mellé, talán azért elfér egy, ahol a baktérium patomechanizmusáról írunk, arról, hogy miként is kavarja.
Úgy tűnik, hogy az EHEC-járvány lecsengőben van, így kicsit megkésve csapnánk e témában a lecsóba. De talán jobb később, mint soha, és a rengeteg egészségügyi témájú cikk mellé, talán azért elfér egy, ahol a baktérium patomechanizmusáról írunk, arról, hogy miként is kavarja.
Az EHEC betűszó (és ezt talán már mindenki tudja) az "Enterohaemorrhagic E. coli" rövidítése, vagyis egy olyan coli baktérium törzsre utal, amely az emésztőrendszer bevérzését és vérzéses okoz. Nem mellékesen durva veseelégtelenséget (erre utal a napokban előkerült másik rövidítés, a HUS - haemolytic uraemic syndrome), ami különösen gyerekeknél végzetes lehet.
Az Escherichia coli egy gyakori bélbaktériumunk (történetesen az egyik legklasszikusabb laboratóriumi élőlényünk is), amely alapesetben nem hogy bajt nem okoz, de kifejezetten segíti az emésztést és nem mellékesen B12 és K vitamin is termel. A káoszt okozó O157:H7 törzse azonban nem alapeset, és genetikailag néhány nagyon fontos ponton eltér az emberi bélrendszerben élő "vad típusú" rokonától. (Ugyan több forrás is azt állítja, hogy a mostani izolátum egészen új, azért ez nem teljesen biztos.) Az O157:H7 tehenek belében él elsősorban (ezek egyébként egészségesek), ahonnan az ürülékükben kerülhet ki és emberre való terjedése a higiéniás szokások khm... szuboptimális alkalmazásának köszönhető.
 Úgy tűnik, hogy az EHEC-járvány lecsengőben van, így kicsit megkésve csapnánk e témában a lecsóba. De talán jobb később, mint soha, és a rengeteg egészségügyi témájú cikk mellé, talán azért elfér egy, ahol a baktérium patomechanizmusáról írunk, arról, hogy miként is kavarja.
Úgy tűnik, hogy az EHEC-járvány lecsengőben van, így kicsit megkésve csapnánk e témában a lecsóba. De talán jobb később, mint soha, és a rengeteg egészségügyi témájú cikk mellé, talán azért elfér egy, ahol a baktérium patomechanizmusáról írunk, arról, hogy miként is kavarja.
Az EHEC betűszó (és ezt talán már mindenki tudja) az "Enterohaemorrhagic E. coli" rövidítése, vagyis egy olyan coli baktérium törzsre utal, amely az emésztőrendszer bevérzését és vérzéses okoz. Nem mellékesen durva veseelégtelenséget (erre utal a napokban előkerült másik rövidítés, a HUS - haemolytic uraemic syndrome), ami különösen gyerekeknél végzetes lehet.
Az Escherichia coli egy gyakori bélbaktériumunk (történetesen az egyik legklasszikusabb laboratóriumi élőlényünk is), amely alapesetben nem hogy bajt nem okoz, de kifejezetten segíti az emésztést és nem mellékesen B12 és K vitamin is termel. A káoszt okozó O157:H7 törzse azonban nem alapeset, és genetikailag néhány nagyon fontos ponton eltér az emberi bélrendszerben élő "vad típusú" rokonától. (Ugyan több forrás is azt állítja, hogy a mostani izolátum egészen új, azért ez nem teljesen biztos.) Az O157:H7 tehenek belében él elsősorban (ezek egyébként egészségesek), ahonnan az ürülékükben kerülhet ki és emberre való terjedése a higiéniás szokások khm... szuboptimális alkalmazásának köszönhető.
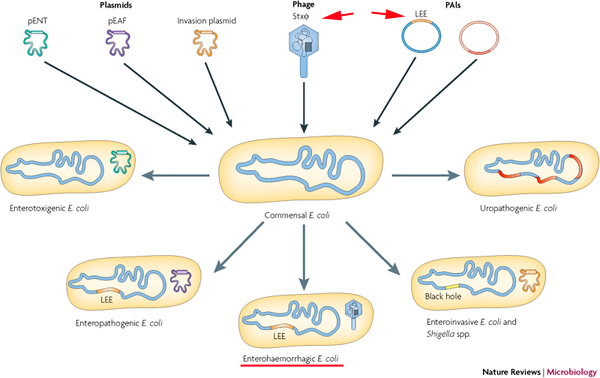
Az O157:H7 és más, nem-EHEC coli közti genetikai különbségek (nem meglepő módon) azokat a fehérje kódoló szekvenciákatt takarják, amelyek a megbetegedés kialakulásáért felelősek. Ezek konkrétan három kategóriába esnek. Egyrészt a baktérium kromoszómájába illeszkedő, ún. "patogenitás sziget" (pathogenicity island - PAI), az LEE, amelynek mint neve is mutatja fontos szerepe van a bélsejtek módosításában (LEE = locus of enterocyte effacement). Másrészt egy bakteriális vírus, azaz fág által kódolt Shiga toxin (Stx), ami - ideiglenesen - beépül a bakteriális genomba (erről bővebben lásd néhány bekezdés múlva). És végül, de nem utolsó sorban a baktérium kromoszómáján kívül levő, önálló sokszorozódásra képes, cirkuláris DNS darab, azaz plazmid, amin a virulenciában fontos gének kapnak helyett, és ami a jól csengő pO157 nevet viseli (és így az EHEC törzs névadója is). Mint látni fogjuk a megbetegedés tüneteit az LEE és a fág kiválóan magyarázzák, igazából a névadó pO157-n levő faktorok "csak" optimalizálják a működést, például nekik köszönhetően a baktérium jobban bírja a marhák gyomrának savas közegét.
A bélrendszerbe jutó O157:H7 baktérium a vastagbélig viszonylag passzív magatartást folytat, ott azonban aktiválja magát. Ebben fontos szerepe van a baktériumok különleges tulajdonságának, a kvórum érzékelésnek (quorum sensing). Ez tömören azt jelenti, hogy a baktériumok termelnek egy adott anyagot, ami adott koncentrációban képes bizonyos géneket aktiválni. "Adott koncentrációt" csak egy-egy nagyobb közösség érhet el, vagyis ezek a gének akkor aktiválódnak, ha a környezetben sok más baktérium van. Az O157:H7 egy elég általános kvórum érzékelést használ, ami arra jó, hogy jelezze, mikor is ér a vastagbélbe: ez ugyanis a bennünk lakó baktériumok fő lakóhelye. A baktérium aktiválódása azt jelenti, hogy többé nem sodródik viszonylag passzívan a bélrendszerben, hanem saját kezébe veszi sorsa irányítását és letapad a bélfalon, a bélsejtek apró kitüremkedésein, a mikrovilusokon.
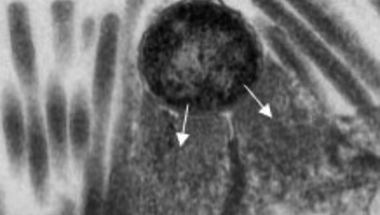
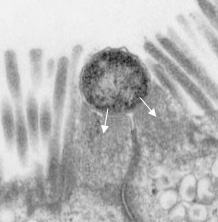
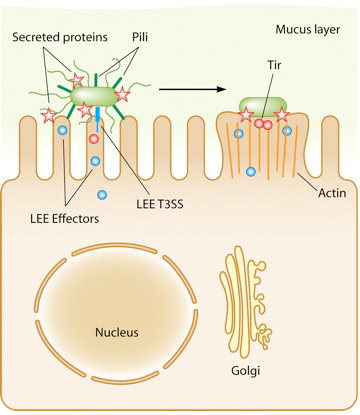 A tapadásban fontos szerepet játszanak az LEE génjei. Ezek egy miniatűr "injektort" is kódolnak, egy hármas típusú szekréciós rendszert (T3SS), amely révén a baktérium az LEE által kódolt további fehérjéket (ún. effektorokat) juttat a bélsejtbe. Utóbbiak közül az egyik legfontosabb a Tir nevű, amely a bélsejt felszínére jut ki majd, és ott kapcsolódik a baktérium membránjában levő Intimin fehérjéhez. Vagyis a bakteriális és bélsejt kapcsolata egyre szorosabbá válik. Közben a további effektorok a bélsejt belső vázát, így végső soron alakját kialakító fehérjéket (pl. aktin) kezdik el szabályozni. Ennek a folyamatnak az eredményeként a baktérium alatti részeken az aktin polimerizációjának köszönhetően egy kis pódium alakul ki, amelyen a sejt a maga teljes hosszában elterülhet, mintegy piedesztálra emelődik (ennek az elektronmikroszkópos képe látható a poszt legelején).
A tapadásban fontos szerepet játszanak az LEE génjei. Ezek egy miniatűr "injektort" is kódolnak, egy hármas típusú szekréciós rendszert (T3SS), amely révén a baktérium az LEE által kódolt további fehérjéket (ún. effektorokat) juttat a bélsejtbe. Utóbbiak közül az egyik legfontosabb a Tir nevű, amely a bélsejt felszínére jut ki majd, és ott kapcsolódik a baktérium membránjában levő Intimin fehérjéhez. Vagyis a bakteriális és bélsejt kapcsolata egyre szorosabbá válik. Közben a további effektorok a bélsejt belső vázát, így végső soron alakját kialakító fehérjéket (pl. aktin) kezdik el szabályozni. Ennek a folyamatnak az eredményeként a baktérium alatti részeken az aktin polimerizációjának köszönhetően egy kis pódium alakul ki, amelyen a sejt a maga teljes hosszában elterülhet, mintegy piedesztálra emelődik (ennek az elektronmikroszkópos képe látható a poszt legelején).
Ez önmagában azonban még nem okozna súlyos galibát, utóbbi a már említett Shiga toxinnak köszönhető. A toxin két alegységből áll, az egyik (B) amolyan hordozóként segíti a másik sejtbe, majd citoplazmába jutását. Ott aztán ez az A alegység hasítás révén aktiválódik, majd módosítja a fehérjeszintézisért felelős riboszómák 28S RNS alegységét. Ezzel megszűnik a fehérjeszintézis és a sejt menthetetlenül elpusztul. A bélsejtek pusztulása aztán kiváltó oka a hasmenésnek, amely során a kevésbé emésztődő tápanyag mellett a bélborításunk (pontosabban annak sejttörmelék formájú maradéka) is távozik a szervezetből (nyugi, ez nem egy visszafordíthatatlan károsodás, ezek a sejtek természetes úton is lecserélődnek, csak nem ilyen gyorsan így eltart egy ideig, amíg visszaáll a rend).
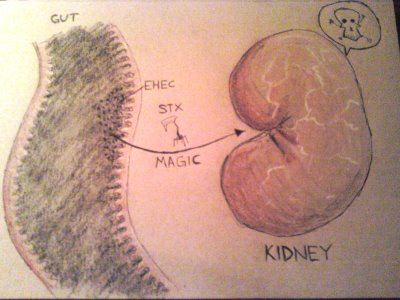 A követlező logikus kérdés, hogy a toxin miképp jut emberekben a vesébe, ahol a már említett HUS-t okozhatja. Röviden: fogalmunk sincs. Mivel maga az EHEC baktérium nem invazív (azaz nem jut ki a belekből), a toxin egymagában teszi meg a bélből a véráramba, majd a vérből a vesébe történő utat. Fura módon ez a folyamat elég ember-specifikusnak tűnik, hiszen szarvasmarhákban, ahol az egész fertőzés sokkal-sokkal enyhébb lefolyású, ennek nem lelték nyomát.
A követlező logikus kérdés, hogy a toxin miképp jut emberekben a vesébe, ahol a már említett HUS-t okozhatja. Röviden: fogalmunk sincs. Mivel maga az EHEC baktérium nem invazív (azaz nem jut ki a belekből), a toxin egymagában teszi meg a bélből a véráramba, majd a vérből a vesébe történő utat. Fura módon ez a folyamat elég ember-specifikusnak tűnik, hiszen szarvasmarhákban, ahol az egész fertőzés sokkal-sokkal enyhébb lefolyású, ennek nem lelték nyomát.
A Shiga toxinról beszélve (és azért nem lemenve a szakbarbár szintig, ahol számos - nekem - érdekes dolog előkerülne), egy dolgot érdemes kicsit kibontani. Mint említettem a toxint egy fág kódolja, vagyis igazából amikor elkezd termelődni, akkor a baktérium el fog pusztulni. A bakteriális fágok életciklusa ugyanis két jól definiálható szakaszra osztható: a litikus és a lizogén fázisokra.
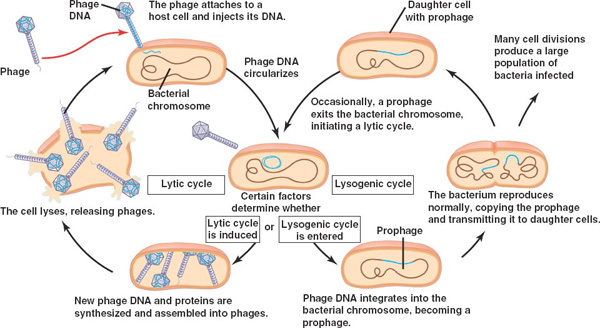 A lizogén fázis során a fág genetikai anyaga beépül a bakteriális kromoszómába és ott inaktív állapotban öröklődik tovább. A környezet ekkor kb. optimális, így a fág igazi "önző génként" viselkedik, számára megéri potyázni hiszen minden osztódáskor a bakteriális sejt a fág-DNSt is sokszorozza. A fág azonban nem hálás albérlő, és ha valami jel érkezik, hogy a baktérium élete nem a tervek szerint halad, az integrálódott, szunnyadó fág (inaktív állapotában: profág) hirtelen bekapcsol és ezzel kezdetét veszi a litikus fázis. Ennek során az immár aktív fág elkezdi a saját fehérjéinek (köztük a Stx-nek) a termelését. A milliónyi kis fággal tömött bakteriális sejt aztán kirobban, és a fágok új fertőznivaló után néznek.
A lizogén fázis során a fág genetikai anyaga beépül a bakteriális kromoszómába és ott inaktív állapotban öröklődik tovább. A környezet ekkor kb. optimális, így a fág igazi "önző génként" viselkedik, számára megéri potyázni hiszen minden osztódáskor a bakteriális sejt a fág-DNSt is sokszorozza. A fág azonban nem hálás albérlő, és ha valami jel érkezik, hogy a baktérium élete nem a tervek szerint halad, az integrálódott, szunnyadó fág (inaktív állapotában: profág) hirtelen bekapcsol és ezzel kezdetét veszi a litikus fázis. Ennek során az immár aktív fág elkezdi a saját fehérjéinek (köztük a Stx-nek) a termelését. A milliónyi kis fággal tömött bakteriális sejt aztán kirobban, és a fágok új fertőznivaló után néznek.
Felvetődhet a kérdés, hogy akkor egyáltalán miért maradt fenn az O157:H7, magában szunnyadó profágot, azaz egy időzített bombát hordozó törzs. Hiszen a logika azt diktálná, hogy ez a vonal folyamatos hátrányban legyen az evolúciós versenyben más E. coli törzsekkel szemben. És ez az a pont ahol a történet érdekes irányt vesz, mert kiderült létezik olyan kontextus, ahol a profág tulajdonlása evolúciós előnyt jelent. Ez pedig nem más, mint a baktériumokat fogyasztó ragadozók jelenléte.
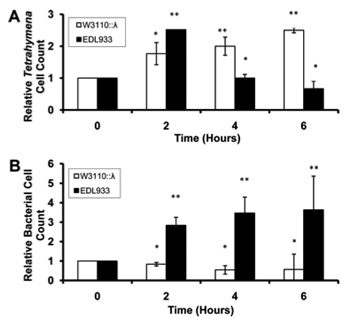 Ilyen ragadozó például a Tetrahymena thermophila nevű csillós egysejtű.
Ilyen ragadozó például a Tetrahymena thermophila nevű csillós egysejtű.
Ha ezt a protozoát Stx termelésre képes EDL933 (ez az O157:H7 egy másik elnevezése) és toxint nem termelő W3110 törzsekkel tesszük egy helyre, akkor néhány óra múlva látványos különbség figyelhető meg, mind a bakteriális sejtek számában, mind a Tetrahymena egyedek számában: a toxin termelő bacik szép számban megmaradtak, míg a Tetrahymenak közt jelentős pusztulás figyelhető meg, ami különösen látványos ahhoz képest, hogy toxin nélkül épp az ellenkező eredményt kapjuk.
Az aktiválódó profág okán Stx termelő egyedek elpusztulnak ugyan, de a ragadozók kiiktatásával (hiszen az eukarióta Tetrahymena esetében a fent említett riboszóma blokkolás és sejthalál-indukció épp úgy működik) tovább élhet a profág-hordozó populáció.
Vagyis, bármennyire is sérti esetleg ez az egónkat, egy evolúciós fegyverkezési versenyben vagyunk amolyan (jobb szó híján) "collateral damage". Az EHEC Stx termelése súlyos következményekkel járhat emberben, de ez nem ellenünk irányul. Mindössze arról van szó, hogy egyes emberekben a bél belső miliője inkább alkalmas arra, hogy az EHEC-ben szunnyadó profágot akaratlanul is "felébresszék", így alakítva ki az ismert, szélsőséges esetben letális szindrómát. Érdekes kérdés (és tudomásom szerint megválaszolásra vár), hogy mi befolyásolhatja ezt a folyamatot, miért ilyen nagy a szórás egyes emberek EHEC-re adott válaszreakciója közt (és miért különbözik ennyire a bennünk kialakuló reakció a marhákban megfigyelhetőtől). Ha mindezt megértjük, akkor jó eséllyel kezelni is tudjuk majd a betegséget.
Update: Így utólag látom, hogy most nem is az O157:H7, hanem az O104:H4 a bűnös törzs, de a lényegen ez persze nem változtat.
Lim JY, Yoon J, Hovde CJ (2010) A brief overview of Escherichia coli O157:H7 and its plasmid O157. J Microbiol Biotechnol 20(1): 5-14.
Ahmed N, Dobrindt U, Hacker J, Hasnain SE (2008) Genomic fluidity and pathogenic bacteria: applications in diagnostics, epidemiology and intervention. Nat Rev Microbiol 6(5): 387-94.
Lainhart W, Stolfa G, Koudelka GB (2009) Shiga toxin as a bacterial defense against a eukaryotic predator, Tetrahymena thermophila. J Bacteriol 191(16): 5116-22.
Moxley RA (2004) Escherichia coli 0157:H7: an update on intestinal colonization and virulence mechanisms. Anim Health Res Rev 5(1): 15-33.