 Mutációk vannak, és ennek ezer bizonyítékát látjuk, például a gyorsan változó vírustörzsekben, a rezisztenssé váló baktériumokban. Szekvencia szinten is be tudjuk azonosítani őket, akár egymást követő generációkban, és különböző ötletes kísérletekkel meg tudjuk határozni az egyes élőlények ún. mutációs rátáját is, vagyis azt a gyakoriságot, hogy egy-egy mutáció rögzüljön.
Mutációk vannak, és ennek ezer bizonyítékát látjuk, például a gyorsan változó vírustörzsekben, a rezisztenssé váló baktériumokban. Szekvencia szinten is be tudjuk azonosítani őket, akár egymást követő generációkban, és különböző ötletes kísérletekkel meg tudjuk határozni az egyes élőlények ún. mutációs rátáját is, vagyis azt a gyakoriságot, hogy egy-egy mutáció rögzüljön.
Bár kétségtelen, hogy a mutációk léte és örkölhetősége az evolúció egyik hajtóereje, az is biztos, hogy a legtöbb mutáció gondot okoz a gazdájának, adott esetben letális is lehet, ezért a legtöbb élőlény igyekszik minimalizálni a mutációk számát, különböző molekuláris mechanizmusok révén. A legtöbb DNS másolást végző enzim, azaz polimeráz, beépített hibajavító mecahnizmusokkal rendelkezik, s ha valami átcsúszna ezen a szitán még mindig akadnak másodlagos javító rendszerek.
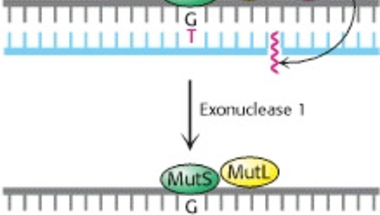
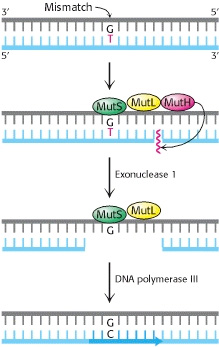
Jobb oldalon az Escherichia coli baktérium hibajavító rendszere látható (a kép innen származik), amelynek logikája a következő: ha a DNS másolásba hiba csúszott, a rosszul párosodó bázispárhoz a MutS nevű fehérje fog kapcsolódni, ami ekkor egy másik fehérjét, a MutL-t is képes lesz megkötni. Utóbbi pedig a MutH-t vonza a probléma helyszínére. Ez egy szakaszon elemészti az újonnan szintetizált, mutációt hordozó DNS-t és a létrejövő lyukat a polimeráz betömi.
A rendszer viszonylag jól működik, csak akkor csúszik hiba a dologba, ha nem elég gyors a javítás: a MutH annak alapján tudja eldönteni, hogy a kettős spirál melyik tagja új, hogy a metilációs mintázatokat figyeli. Az új szál nem metilált, viszont ez csak ideig óráig marad így, mert egy másik enzim előbb-utóbb ráakasztja a metil-csoportokat a megfelelő pozícióba. Ha eddig a pontig a MutH nem végezte el a feladatát, ezután már nem tudja, mert nem tud különbséget tenni a két szál között, így a mutáció megmarad.
Bár a hibás DNS másolás nyomait nem ördöngösség meglelni és olyan egyedek vizsgálatával, ahol a mutációk száma megszaporodik, be tudjuk azonosítani azokat a fehérjéket is, amelyek a sejten belül próbálnak őrködni a genetikai anyag épsége felett, a mutáció kialakulásának pillanatát szinte lehetetlen elkapni. Ez egyrészt technikai jellegű probléma, hiszen hogyan veszed észre, hogy épp mutáció keletkezett, másrészt millió/milliárd bázispár egyszerre történő megfigyelése szintén nem triviális.
 Mutációk vannak, és ennek ezer bizonyítékát látjuk, például a gyorsan változó vírustörzsekben, a rezisztenssé váló baktériumokban. Szekvencia szinten is be tudjuk azonosítani őket, akár egymást követő generációkban, és különböző ötletes kísérletekkel meg tudjuk határozni az egyes élőlények ún. mutációs rátáját is, vagyis azt a gyakoriságot, hogy egy-egy mutáció rögzüljön.
Mutációk vannak, és ennek ezer bizonyítékát látjuk, például a gyorsan változó vírustörzsekben, a rezisztenssé váló baktériumokban. Szekvencia szinten is be tudjuk azonosítani őket, akár egymást követő generációkban, és különböző ötletes kísérletekkel meg tudjuk határozni az egyes élőlények ún. mutációs rátáját is, vagyis azt a gyakoriságot, hogy egy-egy mutáció rögzüljön.
Bár kétségtelen, hogy a mutációk léte és örkölhetősége az evolúció egyik hajtóereje, az is biztos, hogy a legtöbb mutáció gondot okoz a gazdájának, adott esetben letális is lehet, ezért a legtöbb élőlény igyekszik minimalizálni a mutációk számát, különböző molekuláris mechanizmusok révén. A legtöbb DNS másolást végző enzim, azaz polimeráz, beépített hibajavító mecahnizmusokkal rendelkezik, s ha valami átcsúszna ezen a szitán még mindig akadnak másodlagos javító rendszerek.
Jobb oldalon az Escherichia coli baktérium hibajavító rendszere látható (a kép innen származik), amelynek logikája a következő: ha a DNS másolásba hiba csúszott, a rosszul párosodó bázispárhoz a MutS nevű fehérje fog kapcsolódni, ami ekkor egy másik fehérjét, a MutL-t is képes lesz megkötni. Utóbbi pedig a MutH-t vonza a probléma helyszínére. Ez egy szakaszon elemészti az újonnan szintetizált, mutációt hordozó DNS-t és a létrejövő lyukat a polimeráz betömi.
A rendszer viszonylag jól működik, csak akkor csúszik hiba a dologba, ha nem elég gyors a javítás: a MutH annak alapján tudja eldönteni, hogy a kettős spirál melyik tagja új, hogy a metilációs mintázatokat figyeli. Az új szál nem metilált, viszont ez csak ideig óráig marad így, mert egy másik enzim előbb-utóbb ráakasztja a metil-csoportokat a megfelelő pozícióba. Ha eddig a pontig a MutH nem végezte el a feladatát, ezután már nem tudja, mert nem tud különbséget tenni a két szál között, így a mutáció megmarad.
Bár a hibás DNS másolás nyomait nem ördöngösség meglelni és olyan egyedek vizsgálatával, ahol a mutációk száma megszaporodik, be tudjuk azonosítani azokat a fehérjéket is, amelyek a sejten belül próbálnak őrködni a genetikai anyag épsége felett, a mutáció kialakulásának pillanatát szinte lehetetlen elkapni. Ez egyrészt technikai jellegű probléma, hiszen hogyan veszed észre, hogy épp mutáció keletkezett, másrészt millió/milliárd bázispár egyszerre történő megfigyelése szintén nem triviális.
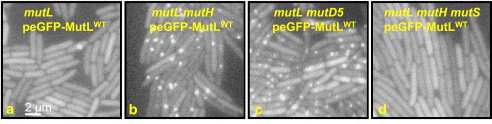 Mégis ezzel kísérletezett most egy csoport, és igen jópofa eredményeket kaptak. A rendszer lényege, hogy egy olyan MutL fehérjét hoztak létre, amihez egy zölden fluoreszkáló fehérje darabot fűztek. Ha ezt az új, rekombináns fehérjét bevitték egy, a mutL génben egyébként mutáns baktérium törzsbe, akkor kb nomrális mutációs rátájú transzgénikus törzs keletkezett. Annyiban különbözött "vad típusú" kollegáitól, hogy időnként egy-egy zöld pont jelent meg egy-egy baktérium kormoszómáján (a), ami idővel eltűnt. Mivel tudjuk, hogy általában több mint egy MutL fehérje köt a pontmutációk környékén, kézenfekvő feltételezni, hogy a zöld pontok pontmutációnak felelnek meg.
Mégis ezzel kísérletezett most egy csoport, és igen jópofa eredményeket kaptak. A rendszer lényege, hogy egy olyan MutL fehérjét hoztak létre, amihez egy zölden fluoreszkáló fehérje darabot fűztek. Ha ezt az új, rekombináns fehérjét bevitték egy, a mutL génben egyébként mutáns baktérium törzsbe, akkor kb nomrális mutációs rátájú transzgénikus törzs keletkezett. Annyiban különbözött "vad típusú" kollegáitól, hogy időnként egy-egy zöld pont jelent meg egy-egy baktérium kormoszómáján (a), ami idővel eltűnt. Mivel tudjuk, hogy általában több mint egy MutL fehérje köt a pontmutációk környékén, kézenfekvő feltételezni, hogy a zöld pontok pontmutációnak felelnek meg.
De a feltételezés még nem bizonyíték, és azt sem tudjuk, vajon mindenféle pontmutáció "bezöldül", vagy csak azok, amelyek nem javítódnak ki? Ezek eldöntésére két kísérletet végezhetünk. Egyrészt megnézzük a zöld pöttyök ("fókuszok") számát, olyan baktériumokban, ahol a javító mechanizmus valamelyik más eleme elromlik (ez praktikus okokból a mutH kell legyen, mert ha a mutS hiányzik a rendszerből, a fent részletezett okok miatt, a MutL sem tud majd a DNS-hez kötni, lásd (d)), és olyanokban, ahol a polimeráz bépített hibajavítása nem működik (pl. a mutD5 törzs). Mindkét esetben lényegesen megnő a fókuszok száma ((b) és (c)), ami azt jelenti, hogy amit látunk azok a ki nem javított pontmutációk (ha ugyanis a kijavításra kerülők is láthatóak lesznek, akkor a mutH törzsben észlelt fókuszok száma nem különbözhetne nagyon a kontroll csoporttól).
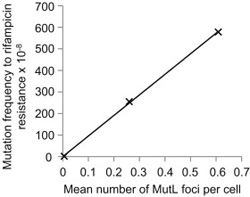 A másik kísérlet pedig annak az összevetése, hogy miképpen korrelál a mutációk száma és a fókuszok száma. Ez pedig lineáris összefüggésnek bizonyult.
A másik kísérlet pedig annak az összevetése, hogy miképpen korrelál a mutációk száma és a fókuszok száma. Ez pedig lineáris összefüggésnek bizonyult.
Azaz, látható fluoreszcens jel csak akkor alakul ki, amikor a létrejövő pontmutációk hosszú ideig megmaradnak, mert a bekövetkező metiláció miatt javításuk nem következhet be (magyarán fixálódnak).
Ugyan a kísérleti rendszer nem teszi lehetővé, hogy lássuk, fizikailag mi is a bekövetkező mutáció, azt élőben követhetjük nyomon, hogy milyen gyakorisággal mutálódik a bakteriális genom.
Elez M, Murray AW, Bi L-J, Zhang X-E, Matic I, Radman M (2010) Seeing Mutations in Living Cells Curr Bio 20: 1432-1437.