 Az amerikai rövid-farkú cickány (Blarina brevicauda) cukisága megtévesztő, hiszen azon kevés emlősfajok közé tartozik, amelyek bénítani tudnak mérgező harapásukkal.
Az amerikai rövid-farkú cickány (Blarina brevicauda) cukisága megtévesztő, hiszen azon kevés emlősfajok közé tartozik, amelyek bénítani tudnak mérgező harapásukkal.
Nyálának méreganyaga a BLTX, amely jellegét tekintve egy kallikrein típusú proteáz (azaz fehérje hasító) enzim, amely működése során egy bradykinin nevű molekulát hoz létre, s nagy koncentrációban ez bénulást illetve halált okoz (a cickány prédájában).
A mérgező állatok közös tulajdonsága, hogy nem mérgező ősökből alakultak ki, ami egyszersmind azt is jelenti, hogy minden egyes esetben a méreganyaguknak van valamilyen nem-mérgező evolúciós "eredete". Nincs ez természetesen másként a szóban forgó cickány faj esetében sem, így természetesen érdemes utánaeredni, honnan is származik a BTX.
 Az amerikai rövid-farkú cickány (Blarina brevicauda) cukisága megtévesztő, hiszen azon kevés emlősfajok közé tartozik, amelyek bénítani tudnak mérgező harapásukkal.
Az amerikai rövid-farkú cickány (Blarina brevicauda) cukisága megtévesztő, hiszen azon kevés emlősfajok közé tartozik, amelyek bénítani tudnak mérgező harapásukkal.
Nyálának méreganyaga a BLTX, amely jellegét tekintve egy kallikrein típusú proteáz (azaz fehérje hasító) enzim, amely működése során egy bradykinin nevű molekulát hoz létre, s nagy koncentrációban ez bénulást illetve halált okoz (a cickány prédájában).
A mérgező állatok közös tulajdonsága, hogy nem mérgező ősökből alakultak ki, ami egyszersmind azt is jelenti, hogy minden egyes esetben a méreganyaguknak van valamilyen nem-mérgező evolúciós "eredete". Nincs ez természetesen másként a szóban forgó cickány faj esetében sem, így természetesen érdemes utánaeredni, honnan is származik a BTX.
Az első dolog amire felfigyelhetünk, ha a BTX-et más kallikrein enzimekkel összevetjük, az az, hogy a fehérje aminosavsorrendje egy kicsit megváltozott, új szakaszok épültek bele, egész pontosan olyan helyekre, ahol a három dimenziós szerkezetben az enzim kötőhelyét körbevevő hurkok vannak. Ezek már önmagukban is gyanúsak lennének, de közelebbi vizsgálódás kiderítette, hogy a cickányban két másik (nem mérgező) kallikrein enzim is található (blarinasin-1 ill. -2 (B1 és B2)), amelyek szintén hordozzák ezeket az inszerciókat.
Vagyis az extra aminosavak önmagukban nem okozhatják a mérgező hatást. Viszont van egy látványos különbség is: a BTX esetében az extra aminosavak fizikai jellege jellegzeteen eltére a blarinasin fehérjék esetében látottaktól. Ezek az aminosavak pozitív töltést kölcsönöznek a fehérjehurkoknak, és valószínűsíthető, hogy ez a változás okozza az enzim felfokozott aktivitását. (Ugyanis erről van szó: a bradykinin egy természetes szabályozó molekulája szervezetünknek, amely kis koncentrációban, a sima izmok üsszehúzódása révén, értágulást okoz, csak a nagy dózis a halálos.)
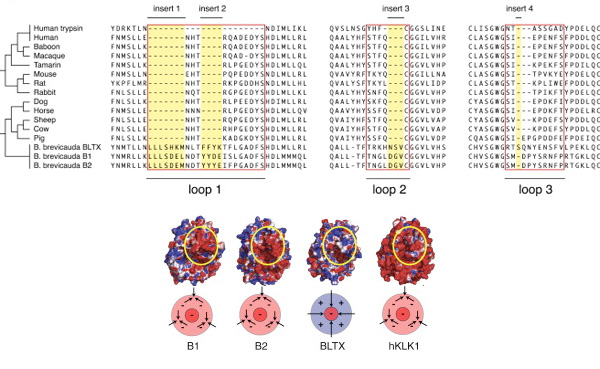
Ami érdekessé teszi a dolgot, hogy a mexikói viperagyík méreganyaga a GTX ugyancsak egy kallikrein enzim módosulásával keletkezett, és közelebbi vizsgálattal az is kiderült róla, hogy szintén új aminosavak inszerciója jellemzi a kialakulását - a különbség mindössze annyi, hogy ezek az aminosvak egy teljesen másik helyre ékelődtek be, mint a cickány BTX inszerciók, ellenben a hatásuk ugyanaz: az enzim kötőhelyének környékét alakítják át.
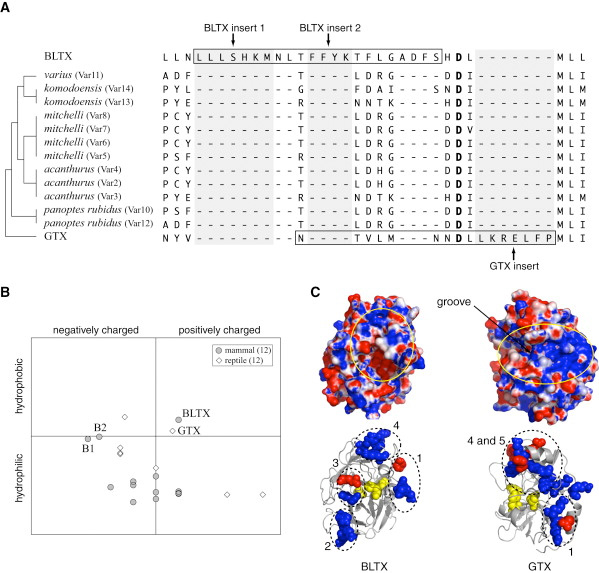
A BTX és GTX kialakulása a konvergens evolúció szép példája, ugyanakkor "méregfronton" nem az egyetlen: a kacsacsőrű emlős mérge például ugyanúgy beta-defensin génekből alakult ki, mint sok hüllő méreganyaga. Az erről szóló poszt következtetése pedig még most is áll: "még az olyan előzmény nélkülinek és drámainak tűnő evolúciós újítások, mint a méregkiválasztás, sem a semmiből keletkeznek, illetve egy jól alkalmazható receptre (kisebb-nagyobb változtatásokkal) néha többször is "rálel" a természetes szelekció"
(A cickány képe a Wikimedia commonsról van.)
Aminetzach YT, Srouji JR, Kong CY, Hoekstra HE. (2009) Convergent evolution of novel protein function in shrew and lizard venom. Curr Biol 19(22): 1925-1931.







