 (Vendégmunkásunk, SexComb újabb posztja.)
(Vendégmunkásunk, SexComb újabb posztja.)
Gyakran esik szó a mutációról,
mint fogalomról, azonban valahogy az az érzésem, hogy sokaknak elég
ködös ezen változások mibenléte, így úgy gondolom, érdekes lehet
egy összefoglaló jellegű írás erről a kérdésről.
Mutációnak nevezzük a sejt
örökítőanyagának megváltozását. Ennyi. Mivel a földi élet
örökítőanyaga a DNS, így a mutációk az adott sejt DNS bázissorrendjének,
azaz szekvenciájának a megváltozását jelentik. Alapvetően három
különböző fajta mutációt különítünk el, ezek a báziscsere,
a deléció és a duplikáció. A báziscsere, más néven pontmutáció,
mint a neve is mutatja, egy nukleotid megváltozása. Teszem azt egy
ACGTGCCAGCTCTTG szakaszból egy pontmutáció során ACGTGCGAGCTCTTG
válik, azaz egy citozin guaninra változott. Deléciónak nevezzük,
amikor az eredeti nukleotidszekvenciához képest hiányoznak bázisok,
mintegy törlődnek. Például a ACGTGCCAGCTCTTG szakaszból
ACGTGAGCTCTTG lesz egy deléció nyomán. Inszerciónak nevezzük
ha az eredeti szekvenciába fölös bázisok épülnek be, például
a ACGTGCCAGCTCTTG szakaszból ACGTGAACCAGCTCTTG lesz egy
inszerció nyomán.
Megkülönböztetünk ezen kívül kromoszóma-mutációkat, ekkor a DNS szakaszban akkora méretű változás következik be, amely már a kromoszóma mikroszkópban látható szerkezetét is megváltoztatja. Mivel a többsejtűek kromoszómái tulajdonképpen egyetlen meglehetősen hosszú kettősszálú DNS molekulából állnak, így ezek a mutációk lényegüket tekintve egyedül az érintett DNS szakasz méretében különböznek a fentebb leírt változásoktól.
 (Vendégmunkásunk, SexComb újabb posztja.)
(Vendégmunkásunk, SexComb újabb posztja.)
Gyakran esik szó a mutációról,
mint fogalomról, azonban valahogy az az érzésem, hogy sokaknak elég
ködös ezen változások mibenléte, így úgy gondolom, érdekes lehet
egy összefoglaló jellegű írás erről a kérdésről.
Mutációnak nevezzük a sejt
örökítőanyagának megváltozását. Ennyi. Mivel a földi élet
örökítőanyaga a DNS, így a mutációk az adott sejt DNS bázissorrendjének,
azaz szekvenciájának a megváltozását jelentik. Alapvetően három
különböző fajta mutációt különítünk el, ezek a báziscsere,
a deléció és a duplikáció. A báziscsere, más néven pontmutáció,
mint a neve is mutatja, egy nukleotid megváltozása. Teszem azt egy
ACGTGCCAGCTCTTG szakaszból egy pontmutáció során ACGTGCGAGCTCTTG
válik, azaz egy citozin guaninra változott. Deléciónak nevezzük,
amikor az eredeti nukleotidszekvenciához képest hiányoznak bázisok,
mintegy törlődnek. Például a ACGTGCCAGCTCTTG szakaszból
ACGTGAGCTCTTG lesz egy deléció nyomán. Inszerciónak nevezzük
ha az eredeti szekvenciába fölös bázisok épülnek be, például
a ACGTGCCAGCTCTTG szakaszból ACGTGAACCAGCTCTTG lesz egy
inszerció nyomán.
Megkülönböztetünk ezen kívül kromoszóma-mutációkat, ekkor a DNS szakaszban akkora méretű változás következik be, amely már a kromoszóma mikroszkópban látható szerkezetét is megváltoztatja. Mivel a többsejtűek kromoszómái tulajdonképpen egyetlen meglehetősen hosszú kettősszálú DNS molekulából állnak, így ezek a mutációk lényegüket tekintve egyedül az érintett DNS szakasz méretében különböznek a fentebb leírt változásoktól.
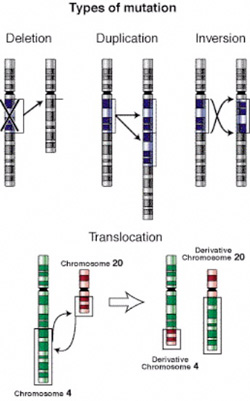 Léteznek
kromoszóma deléciók, ekkor egy kromoszómaszakasz
törlődik. Az érintett szakaszon található
gének természetesen eltűnnek. Léteznek
kromoszóma duplikációk, ekkor egy
kromoszómaszakasz megkétszereződik. Ilyenkor az
érintett szakaszon található gének mind
megkétszereződnek.
Léteznek
kromoszóma deléciók, ekkor egy kromoszómaszakasz
törlődik. Az érintett szakaszon található
gének természetesen eltűnnek. Léteznek
kromoszóma duplikációk, ekkor egy
kromoszómaszakasz megkétszereződik. Ilyenkor az
érintett szakaszon található gének mind
megkétszereződnek.
Inverziónak nevezzük, amikor egy kromoszómaszakasz, általában kromoszómatörések nyomán "megfordul", azaz maga a kromoszómaszakasz mintegy kivágódik és fordított állásban forr össze újra. Transzlokációnak nevezzük azt a mutációt, amikor egy kromoszómaszakasz letörik az egyik kromoszómáról és egy másikra forr oda, az érintett szakasz másik kromoszómára kerül át. Az inverzió és a transzlokáció annyiban különleges esetei a kromoszóma mutációknak, hogy amennyiben a töréspontjaik nem érintenek egyetlen gént sem, rendszerint nem jelennek meg a fenotípusban, mivel minden gén megvan, ráadásul a szükséges példányszámban, így az adott egyed életképességét nem befolyásolják, ám ivarsejtképzéskor komoly gondot okozhatnak. Ezen kívül ismertek egész kromoszómákat érintő duplikációk és deléciók is, ilyenkor az adott kromoszóma a szükségesnél több avagy éppen kevesebb példányban van jelen a sejtben.
Mi okozza a mutációkat? Egyrészt maga a DNS lemásolása sem teljesen hibamentes, a DNS polimeráz enzimek nem tökéletesek, időnként hibás bázisokat építenek be, azaz az Adeninnel szemben nem Timint, a Guaninnal szemben pedig nem Citozint. Ezen kívül néha mikrodeléciók, illetve kisméretű inszerciók is történnek a DNS megkettőződésekor a polimeráz enzim hibájából fakadóan. Ennek esélye enzimenként változik, például az E. coli baktérium DNS polimeráz III. enzimje minden százezredik bázissal szemben nem a neki megfelelő kiegészítő bázist építi be az újonnan előállított DNS szálba, azaz 10-5 eséllyel okoz pontmutációt. Minden sejtben léteznek hibajavító folyamatok, amelyek ezeket a hibákat felismerik és jó eséllyel kijavítják, ezek a ténylegesen bekövetkező mutációk esélyét 10-7 –re csökkentik. Így egyszerűen a DNS átírása sejtosztódáskor körülbelül minden tízmilliomodik bázis mutációját eredményezi. Ez annyit jelent, hogy mivel az E. coli genom valamivel több, mint négy megabázis méretű, így hasonló esélyekkel számolva minden második-harmadik sejtosztódáskor egy új mutáció keletkezik magától, minden külső behatás nélkül. A kólibaktérium 30-40 perces nemzedékeivel számolva ez azt jelenti, hogy egyetlen sejtben háromóránként történik egy új mutáció a polimeráz enzim hibájából. A sejtmagvasok kromoszómáira sejtosztódáskor különösen nagy erők hatnak, ilyenkor fehérjefonalak húzzák a sejt ellentétes oldalaira őket, időnként óhatatlanul megsérül egyik-másik, így kromoszómamutációk is viszonylag gyakran keletkeznek.
Természetesen ismertek mutagének is, amelyek nagyságrendekkel növelik a mutációs gyakoriságot. Például mindenki hallott már arról, hogy az ibolyántúli sugárzás képes károsítani a DNSt és pontmutációkat létrehozni. Nagy energiájú, ionizáló sugárzások is képesek károsítani a DNSt, például a röntgensugárzás gyakran okoz kromoszómatöréseket, így kromoszóma-mutációkat. Léteznek mutagén kémiai anyagok is, például az etil-metán szulfonát (EMS) báziscsere jellegű mutációkat okoz. A már korábban tárgyalt P-elemhez hasonló ugráló genetikai elemek is mutagének, például a P-elem beépülésekor inszerciós mutációkat okoz, kivágódásakor pedig gyakran okoz különböző méretű deléciókat, illetve kromoszómatöréseket. Ezeken kívül rengeteg mutagén hatás, anyag létezik, ezeket nem részletezném, elég sok helyen találni róluk adatokat. Ezeket a hatásokat semmiképpen sem tudjuk kizárni, hiszen valamennyi háttérsugárzás folyamatosan éri az élőlényeket, a táplálékunk rengeteg különböző szervezet anyagcseretermékeit tartalmazza, amelyek között több mutagén ismert, folyamatosan süt minket a nap, ráadásul a sejt saját energiatermelő folyamatai is veszélyes szabadgyökök keletkezésével járnak. Fontos leszögezni, hogy nem különböznek egymástól a "természetes" és a "mesterséges" eredetű mutációk. Mindkét esetben megváltozik a DNS bázissorrendje, ez a változás az első sejtosztódáskor rögzül, a maguktól keletkezett mutációk megkülönböztethetetlenek a mutagén anyagokkal létrehozott változásoktól, teljesen egyenértékűek velük, így nincs értelme "természetes" és "mesterséges" mutációkról beszélni. (Lásd még itt, itt és itt.)
Nagyon fontos, hogy egy mutáció kijavítása csak az első sejtosztódásig lehetséges, amint bekerült a leánysejtekbe, onnantól azoknak a sejteknek az a genomja, ezt örökölték, e szerint működnek. Fontos, hogy milyen sejtben történt a mutáció. Amennyiben egy ivarsejtben, akkor tovább adódik az utódnak, ám amennyiben egy testi sejtben, akkor az ivaros szaporodás során elveszik, hiszen csak az eredeti mutációs eseményt elszenvedő sejt leánysejtjei öröklik, az ivarsejtek nem hordozzák, így nem is adható át az utódoknak. Az ivarsejtekben megjelenő mutációkat csíravonal-mutációknak nevezzük, míg a testi sejtekben történt mutációs eseményeket szomatikus mutációknak. Amennyiben egy ivarsejtben történik meg a mutáció, a belőle kifejlődő utód szervezete semmilyen módon sem törekszik a mutáció kijavítására, az ő számára ez a természetes állapot, nem érzékeli, hogy ő egy mutáns, mivel nincs semmilyen emléke sem a mutáció előtti állapotról, amit mi vad típusnak nevezünk. Például egy cisztás fibrózisban szenvedő beteg szervezete semmilyen módon sem képes kijavítani a betegséget okozó mutációt, az ő számára ez a természetes állapot, még akkor is, ha belehal.
Az újonnan keletkezett mutáció hogyan öröklődik? Egy diploid szervezet, mint amilyen az ember is, minden kromoszómájából, így minden génjéből is két példánnyal rendelkezik, egy apaival és egy anyaival. Amennyiben a kérdéses allél akkor is kialakítja az ő fenotípusát, ha csak az egyik kromoszóma hordozza a kérdéses allélt, a másik a gén vad típusú változatát tartalmazza, akkor az adott allél domináns. Azaz ha heterozigóta állapotban is megjelenik a fenotípusban, a kérdéses allél domináns. Amennyiben kizárólag homozigóta állapotban jelenik meg a fenotípusban, az adott allél recesszív. Az, hogy egy mutáció domináns vagy recesszív allélt eredményez, nem lehet előre megmondani, kizárólag az adott allél ismeretében nyilatkozhatunk róla. Haploid szervezetek esetében nincs értelme domináns vagy recesszív mutációkról beszélni, mivel ilyenkor minden génből csak egyetlen példányt hordoz az adott szervezet, az egyébként recesszív mutációk is megjelennek a fenotípusban. Egyedi, nemhez kötött öröklődést mutatnak az emlősök X kromoszómáján található gének. Mivel az emlősök hímjeiben egy X és egy Y ivari kromoszóma található, a hímek az ezen kromoszómán kódolt génekből csak egyetlen példánnyal rendelkeznek, így esetükben a recesszív allélek is megnyilvánulnak a fenotípusban. Ilyen például az X kromoszómához kötött vérzékenység, vagy hemofília.
Ami a fő kérdés: mit okoz egy adott mutáció? Ezen a szinten vizsgálva lehetetlen megmondani. Az egyes DNS szekvencia változások hatása csak akkor válik egyértelművé, ha megvizsgáljuk, milyen hatással vannak az adott génre. "Gén" alatt a genetikai génfogalmat értem, azaz a fehérjét kódoló DNS szakaszt és az ennek kifejeződését irányító szabályozóelemeket. Egy mutáció hatását legjobban a mutációk Müller-féle csoportosítása ragadja meg. Hermann Joseph Müller szerint léteznek funkcióvesztéses és funkciónyeréses mutációk:
- Amorf mutáció (Funkcióvesztéses): Egy gén amorf mutációja azt jelenti, hogy a gén által kódolt fehérje működése teljesen megszűnik. Lehetséges, hogy a gén szabályozóelemei válnak működésképtelenné, így egyáltalán nem is termelődik a fehérjéből, vagy ha a fehérjét kódoló génszakasz hibás, megtermelődik ugyan a fehérje, de a térszerkezete annyira más, mint a vad típusúé, hogy képtelen ellátni eredeti feladatát. Az amorf mutációkat szokás még null mutációknak is nevezni. Amennyiben a fehérje eredeti működésének ellátásához elégséges a vad típusban termelődő mennyiség fele is, az adott amorf mutáció recesszíven öröklődik, amennyiben a vad mennyiség fele már kevés a fehérje eredeti működésének ellátásához, az adott amorf mutáció dominánsan öröklődik.
- Hipomorf mutáció (Funkcióvesztéses): Egy gén hipomorf mutációja azt jelenti, hogy a gén által kódolt fehérje eredeti működése csökken, de nem szűnik meg teljesen. Ez úgy lehetséges, hogy a kérdéses fehérjéből kevesebb termelődik meg, vagy a fehérje szerkezete torzul és kevésbé működik, mint a vad típusú. Egy hipomorf mutáció lehet domináns és recesszív is, az amorfnál leírtak szerint.
- Hipermorf (Funkciónyeréses): Egy gén hipermorf mutációja annyit jelent, hogy az általa kódolt fehérje működése megnő a mutáció hatására, vagy az adott fehérje mennyisége növekszik meg, vagy a fehérje aktivitása emelkedik. Egy hipermorf mutáció lehet domináns és recesszív is.
- Antimorf (Funkciónyeréses): Egy antimorf mutáció olyan fehérjeterméket eredményez, amely nem csak, hogy nem képes ellátni eredeti működését, hanem a vad típusú fehérje működését is gátolja. Az antimorf mutációk általában érintik a gén fehérjét kódoló szakaszát is. Az antimorf mutációk dominánsak. Gyakran domináns negatívnak is nevezik az antimorf mutációkat.
- Neomorf (Funkciónyeréses): A neomorf mutációk esetében az érintett gén fehérjeterméke valami teljesen más működést mutat, mint a vad típusú fehérje. Megváltozhat ilyenkor a fehérje működése, vagy olyan sejtekben is kifejeződik, amelyekben a vad típusú fehérje nem. A neomorf mutációk rendszerint dominánsak.
A mutációk Müller-féle csoportosítása közelebb visz ugyan az adott mutáció hatásának a megértéséhez, ám tulajdonképpen minden egyes mutáció más és más, nem nagyon mondhatunk róluk általánosságokat. Éppen ezért szeretném bemutatni egy gén néhány különböző alléljét. A kiválasztott gén a Drosophila melanogaster, azaz az ecetmuslica white génje. A gén a muslica ivari kromoszómáján helyezkedik el, azaz az X kromoszómán, így nemhez kötött öröklődést mutat. Az általa kódolt fehérje a barna és a vörös szemfesték termelésévben és a szemsejtekbe juttatásában játszik szerepet, nem mellesleg a gén w1 allélja volt az első Drosophila melanogasterben leírt mutáció, még Thomas Hunt Morgan azonosította 1910 –ben. A white gén számos allélját azonosították az eltelt száz év alatt, ezekből szemezgetnék néhányat.
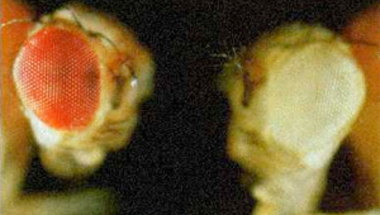
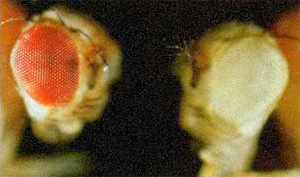
- w1 : Az első azonosított mutáció. Null allél, azaz a fehérje működése teljesen kiesik, a Müller-féle felosztás szerint amorf mutáció, recesszíven öröklődik. A homozigóta nőstények szeme teljesen fehér. Emberi beavatkozás nélkül keletkezett, azaz spontán mutáció. Egy Doc nevű ugráló genetikai elem ugrott a white génbe, ez tette tönkre teljesen.
- wa: A mint apricot, azaz barack. Ez a white gén egy recesszíven öröklődő allélje, a homozigóta legyek szeme halványsárgás, barackszínű, innen a neve is. Ez a mutáció is emberi beavatkozás nélkül történt, a white génbe egy copia ugráló genetikai elem ugrott be, ez csökkentette le a működését. Az allél nem teljesen működésképtelen, így a Müller-féle felosztás szerint hipomorf mutáció, mérések szerint a vad fehérje aktivitásának csak három százalékával rendelkezik, ám ennyi is elég ahhoz, hogy látható mennyiségű festék jusson az állat szemeibe.
- wch: Ch mint cherry, azaz cseresznye, a homozigóta legyek szeme rózsaszínes. Ez a mutáció a w1 allélből alakult ki, amikor egy újabb, pogo típusú ugráló genetikai elem ugrott be a w1 allélbe. A Müller-féle felosztás szerint hipomorf allél, recesszíven öröklődik. Spontán mutáció, minden emberi beavatkozás nélkül alakult ki.
- wBwx: Bwx mint Brownex, a homozigóta egyedek szeme ugyanis barna. Heterozigóta formában is megjelenik a fenotípusban, akinek már nagyon ráállt a szeme, az a heterozigóta állatokat is felismeri, ám a homozigóta egyedekben egyértelmű a fenotípusa, így szemidominánsan öröklődik. A Müller-féle felosztás szerint hipomorf mutáció. Spontán alakult ki, emberi beavatkozás nélkül, a gén fehérjekódoló szakaszában történt egy rövid deléció.
- wDZL: DZL mint Dominant Zeste-like. Ez a mutáció dominánsan öröklődik, a heterozigóta hímek szeme barna, a nőstényeké sárga. Spontán alakult ki, emberi beavatkozás nélkül. Müller-féle besorolása antimorf. Úgy keletkezett, hogy két, egymáshoz közel ülő FB ugráló genetikai elem ugrott egyszerre a white génbe, így azonban az ugráskor magukkal hozták az eredeti beépülési helyük közt lévő szakaszt a muslica genomból, amely így az eredeti white génnel együtt íródik át, egy a vad típusúnál jóval nagyobb méretű fehérjét kódol.
- In(1)wm4h: Ez az allél egy spontán, emberi beavatkozás nélkül létrejött kromoszómamutáció nyomán keletkezett. A Müller-féle besorolása leginkább hipomorf mutáció, recesszíven öröklődik. A kromoszómákon a centromer az a hely, ahová a sejtosztódáskor összeszerelődő húzófonalak kapcsolódnak. Éppen ezért a centromer közelében a DNS szorosan becsomagolt, tömör heterokromatin formában található, ez valószínűleg azért szükséges, hogy megfelelően szilárd legyen a kromoszóma, kibírja a sejtosztódáskor ébredő erőket. Ennek a heterokromatin régiónak a kiterjedése egy egyeden belül is változhat kis mértékben, a pontos határai egyes sejtekben különböző helyeken találhatóak. Ez a mutáció egy inverzió, azaz az X kromoszóma egy szakasza letört a kromoszómáról és fordított állásban forrt vissza. Ez az átrendeződés a white gént a centromer közelébe helyezte át, a heterokromatikus régió határára, így egyes sejtekben, ahol a heterokromatikus régió kicsit kisebb a white gén kifejeződik ezek a szemsejtek pirosak lesznek, más sejtekben, ahol a heterokromatin kiterjedése nagyobb, nem fejeződik ki, ezek a szemsejtek fehérek lesznek. Mindez azt eredményezi, hogy a légy szeme foltos, azaz fehér alapon apró, piros foltok láthatóak. Ebben az esetben a white gén ép, ismereteink szerint a fehérjekódoló szakasz és a szabályozórégió sem sérült, egyszerűen a genomon belüli helye változott meg, ez okozza ezt a fenotípust.
- wbl: Spontán kialakult, recesszív, hipomorf allél. A wa allélből alakult ki egy újabb mutációs esemény nyomán, egy blood ugráló genetikai elem ugrott a white génbe, ez okozza a fenotípust. Ami miatt érdekes: tizenkilenc Celsius-fokon tartva az állatokat a szemük színe sötétvörös, míg harminc Celsius –fokon tartva az állatokat, a szemük színe barnássárga lesz. Az ehhez hasonló mutációkat csúnya szóval kondicionális (feltételes) mutációknak nevezzük, mivel az általuk kialakított fenotípus egy külső körülménytől függ. Ez esetben ez egy hőmérséklet-érzékeny mutáció, a külső hőmérséklet változtatásával a fenotípus is megváltozik.
Nem is sorolnám tovább, a white génnek több mint ezer allélját azonosították az évek során a fenti hivatkozásokon mindenki kedvére csemegézhet. Ez az ezernél több mutáció nyilvánvalóan nem az összes létrejött mutációt jelenti, csak azokat, amelyeket valaki észrevett, törzsbe állított, és valahol leközölt. Amit mindezzel meg szerettem volna világítani: Az egyes mutációk ugyanabból a génből kiindulva számos különböző fenotípust képesek kialakítani. Sokat hallani, hogy a mutációk csak jól behatárolt változásokat képesek létrehozni. Hol vannak ezek a határok? Például a white gén esetében mik a változásnak azok a határai, amelyek már nem léphetőek át? Ebből az egy génből, amely által kódolt fehérje egy jól behatárolt folyamatot katalizál, különböző mutációs események rendkívül eltérő fenotípust adó mutánsokat alakítottak ki. Gyakorlatilag minden olyan génre, amelyet alaposan vizsgáltak számos különböző mutáns allélt azonosítottak, soha semmilyen bizonyítékot sem találtak bármilyen határra, amelyet a mutációk által létrehozott változékonyság ne tudna átlépni. Megfigyelhető, hogy az egyes mutáns allélek sem védettek a további változásoktól, olyan allélek is ismertek, amelyek egy törzsbe állított mutáns allél újbóli mutációjával keletkeztek, ezt csak azért szögezném le, hogy elejét vegyem az olyanfajta elmélkedéseknek, miszerint ezek a mutációk mindig is megvoltak a természetben, csak a kutatók homozigóta állapotba hozták a recesszív alléleket. Kijelenthetjük, hogy az élőlények genomja változik. Mutációk folyamatosan történnek, új allélek folyamatosan alakulnak ki.
A második központi kérdés, hogy egy mutáció hasznos avagy káros? Erre a kérdésre a legnehezebb válaszolni, ugyanis egy mutáció előnyei és hátrányai csak a környezet függvényében értelmezhetőek. Nézzünk néhány emberi példát: A laktóz, más néven tejcukor egy összetett cukor, ebben az alakjában csak akkor hasznosul, hogyha lebomlik egy galaktóztra és egy glükózra, amelyek már a bélből felszívódnak. A laktóz nagy mennyiségben található az emlősök tejében, éppen ezért az emlősök kicsinyei egy ideig termelnek egy laktáz nevű enzimet, amely képes egyszerű cukrokká bontani a tejcukrot. Az emlősök általában csak addig termelnek laktáz enzimet, amíg szopnak, az elválasztás ideje után megszűnik ezen enzim termelése is. Az emberi faj nagy része, a földön élő hétmilliárd ember háromnegyede esetében így is történik, négy-hat éves korukban megszűnik a laktáz enzim termelése, ezáltal a tejcukor emésztésének képessége is. Ez után ha az ember tejet fogyaszt, az emésztetlen tejcukor hasmenést, fokozott gázképződést, bélgörcsöket okoz, szóval roppant kellemetlen. Ezt az állapotot laktózérzékenységnek nevezik, ami öröklött jelleg, az érintett génnek Európában két allélja ismert, a domináns allél a laktáz enzim egész életen át megmaradó termelését, ezáltal a tejivás képességét okozza, a recesszív allélre homozigótákban csak négy-hat éves korukig termelődik laktáz enzim, utána megszűnik ennek a fehérjének a termelése, ezáltal a tej fogyasztásának a képessége is. A két allél közül a recesszív a vad típusú, amely nem teszi lehetővé a tejivást, nyilván ez az ősi változat. Jelenleg is elterjedtebb, mint a tejivást engedő változat, azon kívül a többi emlősállatnál jóformán ismeretlen ez a jelleg. Az alléleloszlás meglehetősen egyenetlen, például Hollandia lakosságának csak 1% -a laktózérzékeny, Kína lakosságának 93% -a ebben a boldog állapotban leledzik, míg a bennszülött amerikaiak 100% -a képtelen tejet emészteni. A magyar lakosság 38% -a laktózérzékeny, mi a középmezőnybe tartozunk. A laktáz enzim egész életen át termelése nyilván egy mutáció eredménye. A korai emberi életkörülmények között ez a mutáció semleges volt. A vadász-gyűjtögető emberek, mint ahogy a mai természeti népek is, semmilyen formában sem fogyasztanak tejet, az ugyanis mint táplálék csak az állattenyésztés kezdete után jelenik meg. Az állattenyésztés kialakulása előtt ez a mutáció semleges, ám az állattenyésztés, egy külső, nem biológiai körülmény kialakulása után ez a mutáció egyértelműen előnyös, hiszen onnantól kezdve a pásztornak nem kell levágnia a tehenet, hogy ehessen belőle, elég, ha megfeji. Viszont onnantól, hogy az ember megkezdte a pásztorkodást, hamarosan kitalált olyan módszereket is, amelyekkel sikerült felülemelkednie ezen az örökletes hátrányon. A joghurt, a kefír, a kemény sajt ugyanazon az elven alapszik: A mikróbák először a legkönnyebben felhasználható tápanyagokat fogyasztják el a környezetükből, a cukrokat, a tej esetében ez a tejcukor, így ha baktériumokkal és/vagy gombákkal erjesztik a tejet, azok jelentősen lecsökkentik a tejcukor-tartalmát, olyan mértékig, amikor már a tejcukor-érzékeny ember is biztonsággal megihatja. Akkor most a laktáz enzim egész életen át termelése előnyös, hátrányos, vagy semleges mutáció? A válasz: a körülményektől függ. Az állattenyésztést nem ismerő környezetben semleges, tejet fogyasztó környezetben előnyös, inkább sajtot/kefírt/joghurtot fogyasztó környezetben semleges. (Erről a mutációról már írtunk korábban itt és itt.)
Vizsgáljunk meg egy másik mutációt, a sarlósejtes vérszegénységet. (Szintén esett már róla szó. ) Ez a mutáció a hemoglobin molekula β-globin láncát kódoló génben következik be. Maga a mutáció recesszív, egyetlen bázis cseréje okozza, a heterozigóták vére működőképes, ám a homozigóták vörösvértestjei torzult alakot vesznek fel és könnyen széttörnek, így a kisebb átmérőjű erekben gyakran károsodnak, időnként összetorlódnak, elzárják az apróbb ereket, ezzel komoly károkat okozva. A mai orvosi ellátás mellett ez a betegség nem feltétlenül halálos, ám a betegek időről-időre orvosi segítségre szorulnak és így is csökken valamelyest a várható élettartamuk. A mai orvoslás előtt sokkal komolyabb volt ez az állapot, sokan belehaltak az erek elzáródásába és az ezzel járó lázrohamokba. Ez a mutáció ezek alapján egyértelműen hátrányos, ha meg is jelenik egy mutációs esemény nyomán, ki kellene szelektálódnia a populációból, hiszen csökkenti az egyed életképességét. Ennek megfelelően Európában rendkívül ritka, negatív szelekció hat rá. No most felfigyeltek rá, hogy Afrikában viszont rendkívül gyakori a sarlósejtes vérszegénység. Miért különbözik ennyire az eloszlása a két népességben? Miért szaporodott fel ennyire ez a káros mutáció Afrikában? A válasz abban keresendő, hogy ezeken a területeken fertőz a malária, amely élősködő életciklusának egy részét a vörösvértestek belsejében tölti, így bújik el az emberi immunrendszer elől. A sarlósejtes vérszegénységre heterozigóta emberek vörösvértestjei, bár az eredeti feladatukat képesek ellátni, szétrepednek, ha a malária élősködője őket fertőzi, így az élősködő képtelen elbújni az emberi immunrendszer elől. Ezek a heterozigóta (Aa) emberek ellenállóak a maláriával szemben, ám egyébként egészségesek. A malária ma is gyakori halálok Afrikában, így az ennek ellenálló egyedek hatalmas előnybe kerültek. Ebben az esetben, ha egy szülőpár mindkét tagja hordozó, ők ellenállóak a maláriával szemben, a gyermekeik negyede vad típusú, fele hordozó, azaz szintén ellenálló, negyede pedig sarlósejtes vérszegénységben szenved. Ebben a környezetben a malária elleni védettség előnye messze felülmúlja a sarlósejtes vérszegénységben szenvedő utódok születéséből származó hátrányt, így ebben a környezetben pozitív szelekció hat erre az allélre, így ez a mutáció a kialakulása után elterjed a populációban. Ebben az esetben a sarlósejtes vérszegénységet okozó mutáció maláriamentes területeken hátrányos és ritka, maláriával fertőzött területeken előnyös és gyakori. Akkor ez most előnyös, vagy hátrányos mutáció?
Egy másik emberi példa a CCR5 gén és az ez által kódolt CCR5 fehérje. Ez egy sejtfelszíni receptorfehérje, amely immunsejtek felszínén található. Valószínűleg a gyulladásos immunválaszban játszik szerepet, ám ez még nem teljesen tisztázott. A CCR5 génnek létezik egy mutáns allélje, a CCR5-D32, amely egy rövid, 32 bázispár méretű delécióval keletkezett, amely tönkreteszi a gén által kódolt fehérjét. A homozigóta és a heterozigóta emberek is egészségesek, így valószínűleg a szervezet valahogyan képes pótolni a kieső működéseket. Ez a mutáns allél meglepően gyakori Európában, a kaukázusi rassz képviselőiben, magyarán szólva a fehér emberekben. Ami miatt érdekes: Ez a CCR5-D32 mutáció véd a HIV fertőzés ellen, a heterozigóták kisebb eséllyel fertőződnek meg a HIV vírussal, míg a homozigóták csak kivételes esetekben kapják el a vírust, gyakorlatilag ellenállónak tekinthetőek. Ellenben úgy tűnik, hogy a homozigóták érzékenyebbek a Nyugat-Nílusi Vírus fertőzésre. Most akkor a CCR5-D32 mutáció hasznos, vagy káros? HIV fertőzött környezetben hasznos, Nyugat-Nílusi Vírus fertőzött környezetben káros. Akkor ez most egy előnyös, vagy hátrányos mutáció?
Valós mutációk vizsgálatával megvilágítható, hogy az az állítás, miszerint hasznos mutációk nem léteznek többek között azért sem igaz, mert egy mutáció hasznossága vagy károssága csak a környezet függvényében értelmezhető. Egy mutáció, ami egy adott időben, adott körülmények között hasznos, egyáltalán nem biztos, hogy egy másik élőhelyen, más körülmények között is előnyös. Érdemes elgondolkodni azon, hogy a Földön hol állandóak a körülmények tartósan? Alig tízezer éve ért véget az utolsó jégkorszak, és máris nyakunkon a globális felmelegedés. A jégkorszak is gyökeresen átalakította a Föld éghajlatát, minden élőlénynek alkalmazkodnia kellett a lehűlésekhez és a felmelegedésekhez is és ezzel együtt minden más éghajlati változáshoz is. A Földön nincsenek állandó élőhelyek, az egyes élőlények környezete folyton változik, így az egyes különböző allélek hasznossága vagy károssága folyton átértékelődik egy adott populáción belül is. Ezen kívül az éghajlat mellett számos tényező gyakorolhat szelekciós nyomást egy adott populációra. Hogy emberi példát mondjak: Amerika felfedezése után nem sokkal nagyon erős, addig ismeretlen szelekciós nyomás alá kerültek az ott élő népek, ugyanis a fehérek által behurcolt járványok szinte megtizedelték az őslakókat, akik ezek ellen gyakorlatilag teljesen védtelennek bizonyultak. Itt például alig néhány év alatt gyökeresen megváltozott ezen népek környezete és a rájuk ható szelekciós nyomás is.
Egy harmadik fontos kérdés, hogy minden mutáció megjelenik-e a fenotípusban, vagyis az örökítőanyag módosulása követhető –e az adott élőlény megfigyelésével? A válasz egyszerű: nem. Számos esetben a mutációnak semmilyen látható vagy mérhető jele sincs. A genetikai kód degenerált, azaz egy aminosavat több különböző bázishármas is kódolhat. Például a GCT, GCC, GCA, GCG bázishármasok is Alanin aminosavvá fordítódnak le, így ha egy pontmutáció következtében például a GCC bázisokból GCA lesz, semmi hatása sem lesz a fehérje működésére, mivel a polipeptidlánc nem változik, ugyanaz az aminosav épül be a kérdéses helyre. Ezen kívül egy-egy aminosav megváltozása nem feltétlenül teszi működésképtelenné a fehérjét, sok olyan pontmutációt, rövidebb deléciót írtak le, amelyek, bár megváltoztatják a fehérje aminosavsorrendjét, a működését nem befolyásolják. A kromoszómamutációk között tárgyaltuk az inverziókat és a transzlokációkat. Ilyen kromoszómaátrendeződések jelenléte nem feltétlenül evidens, gyakran csak alacsonyabb termékenységben nyilvánul meg.
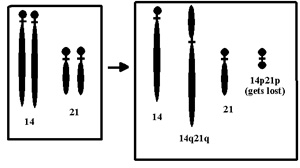 A Down-kórt
leggyakrabban a 21. kromoszóma duplikációja
okozza, azaz ezeknek a betegeknek kettő helyett három 21.
kromoszóma található minden egyes sejtjükben.
Azonban létezik egy másik formája is a
Down-kórnak, a Robertson-féle transzlokáció.
Ekkor a 21. kromoszóma hosszú karja letörik és
egy másik kromoszóma valamelyik karjához forr
oda. (Példaként vegyük a 14. kromoszómát)
E mutánsok általában semmilyen fenotípust
sem mutatnak, hiszen minden génjükből egészen
pontosan két példánnyal rendelkeznek. Azonban
ivarsejtképzéskor a kromoszómák
szétválnak. Ha az utód az ép 21. és
a transzlokációval megnövekedett 14. kromoszómát
örökli a szülőtől, akkor a 21. kromoszóma
transzlokáció által érintett karja három
példányban található meg a sejtjeiben,
így kialakul nála a Down-kór. Amennyiben a
"hosszú" 14. és a "rövid" 21.
kromoszómát örökli, ő egészséges
emberré fejlődik, ám utódai között
ugyanúgy megjelenhetnek Down-kóros gyermekek.
Amennyiben a két vad típusú kromoszómát
örökli a szülőtől, ez a mutáció
elveszett, így utódai egészségesek
lesznek. (A kép innen származik.)
A Down-kórt
leggyakrabban a 21. kromoszóma duplikációja
okozza, azaz ezeknek a betegeknek kettő helyett három 21.
kromoszóma található minden egyes sejtjükben.
Azonban létezik egy másik formája is a
Down-kórnak, a Robertson-féle transzlokáció.
Ekkor a 21. kromoszóma hosszú karja letörik és
egy másik kromoszóma valamelyik karjához forr
oda. (Példaként vegyük a 14. kromoszómát)
E mutánsok általában semmilyen fenotípust
sem mutatnak, hiszen minden génjükből egészen
pontosan két példánnyal rendelkeznek. Azonban
ivarsejtképzéskor a kromoszómák
szétválnak. Ha az utód az ép 21. és
a transzlokációval megnövekedett 14. kromoszómát
örökli a szülőtől, akkor a 21. kromoszóma
transzlokáció által érintett karja három
példányban található meg a sejtjeiben,
így kialakul nála a Down-kór. Amennyiben a
"hosszú" 14. és a "rövid" 21.
kromoszómát örökli, ő egészséges
emberré fejlődik, ám utódai között
ugyanúgy megjelenhetnek Down-kóros gyermekek.
Amennyiben a két vad típusú kromoszómát
örökli a szülőtől, ez a mutáció
elveszett, így utódai egészségesek
lesznek. (A kép innen származik.)
A kromoszómák inverziós mutációi sem feltétlenül okoznak durva elváltozást. Például Simola K. és munkatársai 1977–es cikkükben két családot vizsgáltak meg, amelyek mindketten egy-egy nagy méretű inverziót hordoznak 11. kromoszómán. Az első inverziót az első család három tagja hordozta, a második inverziót pedig a második család nyolc tagja, ám semmilyen kóros eltérést nem tapasztaltak egyiküknél sem. Bár az inverziós mutációk sokszor nem ütköznek ki rögtön, egy fontos hatásuk mégiscsak van: ivarsejtképzéskor, a kromoszómák átkereszteződésekor zavarokat okozhatnak, hiszen ilyenkor nem azonos gének kerülnek egymás közelébe, az utódokban gyakran deléciók és duplikációk keletkeznek. Ezek a kromoszómaátrendeződések homozigóta formában semmilyen hátránnyal sem járnak, ekkor az ivarsejtképzés is akadálytalanul zajlik.
A duplikációk azért különösen érdekesek, mivel ilyen esetekben egy DNS szakasz megkettőződik. Ilyenkor a megkettőződött gének gyakorlatilag felszabadulnak a szelekciós nyomás alól, hiszen szabadon gyűjthetnek mutációkat, ha egy génből két példánnyal is rendelkezik egy szervezet, az egyiknek elégnek kell lennie az élethez, hiszen a duplikáció előtt is csak egy példánnyal rendelkezett, ha a másik elromlik, semmivel sem csökken az életképessége. Sőt, amennyiben esetleg a fölös példányban meglévő gének károsak (Mint például a Down-kórt okozó kromoszómaduplikáció esetén), éppen arra hat szelekciós nyomás, hogy az egyik példány minél előbb megváltozzon valamilyen mutációs esemény nyomán. Ez a magyarázata annak is, hogyan keletkezhetnek új gének a régebbiek módosulásával, úgy, hogy az egyed életképessége ne romoljon. Egy duplikációval keletkezett gént akármilyen mutációs esemény érhet, akármilyen változást elszenvedhet, attól az eredeti példány ép, működőképes marad. Ezek a gének innentől kezdve gyakorlatilag szabadon változnak, ha már egyszer működésképtelenné váltak, a további mutációik egy amúgy is működésképtelen génben történnek. Ráadásul sorozatos duplikációkkal a genom mérete is növekedhet.
Ebben az írásban is gyakran emlegettem a szelekciós nyomás fogalmát. De mi is ez tulajdonképpen? Szelekciós nyomásról akkor beszélünk, ha a különböző tulajdonságokat hordozó egyedek nem egyforma eséllyel élnek túl és szaporodnak. Például az emberi, X-kromoszómához kötött vérzékenység génjére negatív szelekciós nyomás hat, mivel az ezt hordozó férfiak általában fiatalon meghalnak, így egy hordozó nő fiúgyermekeinek a fele elveszik számára, azaz kisebb eséllyel szaporodik. Ez a negatív szelekciós nyomás, az adott allél gyakoriságának a csökkenése felé hat. Hogy a fenti példáknál maradjunk, a HIV vírus elleni védettségre pozitív szelekciós nyomás hat, hiszen az ezt öröklő emberek kisebb eséllyel fertőződnek meg és így ritkábban halnak meg AIDS-ben, mint vad típusú társaik, azaz jobban szaporodnak, így a pozitív szelekciós nyomás ez esetben az adott allél elterjedését segíti. A szelekciós nyomásban is meg szokás különböztetni "természetes" és "mesterséges" szelekciót. Ez teljességgel hibás hozzáállás, a két folyamat semmiben sem különbözik egymástól, a mesterséges szelekció annyit jelent, hogy az állattenyésztő ember dönti el a saját szempontjai szerint, hogy melyik egyed élhet és szaporodhat tovább, ebben az esetben az emberi akarat az adott populáció "környezete", amelyhez alkalmazkodnia kell. Egy hasonló kísérletről már volt szó ebben a blogban is, ám a háziasítás minden esetben hasonlóképpen történik. Viszont be kell, hogy lássuk, hogy ez a szelekciós nyomás semmiben sem különbözik attól, ami a természetben éri az egyes populációkat, egyszerűen bizonyos egyedek elpusztulnak, bizonyos egyedek életben maradnak és szaporodnak.
Végül pedig pár szót egy gyakran előkerülő kijelentésről, miszerint a legtöbb mutáció káros, csak ritkán találni hasznosakat. Ez valóban igaz, mivel a mutációk véletlen folyamatok termékei, a frissen keletkezett mutációk túlnyomó többsége káros egy adott környezetben, csak töredékük hasznos. Viszont a természetes szelekció rövid úton gondoskodik a kevésé életképes egyedek elhalálozásáról, így a hátrányt okozó mutációk viszonylag gyorsan eltűnnek, míg a valamilyen formában előnyös mutációk megmaradnak és elterjednek, mivel hordozóik nagyobb eséllyel szaporodnak.
http://genetika.bio.u-szeged.hu/GenBS/genBS1.html
http://genetika.bio.u-szeged.hu/GenBS/Genmut.ppt
http://genetika.bio.u-szeged.hu/GenBS/genmutMech.ppt
http://genetika.bio.u-szeged.hu/GenBS/KrommutI.ppt
http://genetika.bio.u-szeged.hu/GenBS/Kromszammut.ppt
Simola K., Karli P., De La Chapelle A. (1977): Two pericentric inversions of human chromosome 11. Journal of Medical Genetics 14(5): 371–374.